微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温时,向pH=7的蒸馏水中加入一定量的NaHSO3晶体,保持温度不变,测得溶液的pH=4,下列说法正确的是
A.水电离出的H+的浓度是1.0×10-4 mol·L-1
B.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3)
C.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3)
D.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-)
参考答案:B
本题解析:NaHSO3溶于水后存在如下过程:
NaHSO3=2Na++HSO3-;? HSO3-?H++SO32-;? HSO3-+H2O?H2SO3+OH-;由于溶液的pH=4,即NaHSO3在水溶液中以电离为主,水解为次。即分析得:水电离出的H+的浓度是1.0×10-10mol·L-1 A错;在盐溶液中,离子浓度大小的分析为,未电离和未水解的离子为主,B正确;C选项为物料守恒,正确;D为质子守恒,错误;
本题难度:一般
2、选择题 常温下,若200mL c(H+)=1×10-3mol/L的某一元酸和100mL c(OH-)=1×10-3mol/L的某一元碱溶液混合后,溶液pH>7,所用的酸和碱可能是???????????????( ??)
A.等浓度的弱酸和强碱
B.稀的强酸和稀的强碱
C.稀的弱酸和浓的强碱
D.稀的强酸和浓的弱碱
参考答案:D
本题解析:略
本题难度:简单
3、填空题 (4分)常温下,浓度均为0.1 mol·L-1的①NaHCO3?②NaClO?③NH4Cl?④NaCl?⑤Na2CO3五种溶液的pH由大到小的顺序是___________。
参考答案:②>⑤>①>④>③
本题解析:NaHCO3、Na2CO3、NaClO属于弱酸强碱盐,水解呈碱性,溶液的pH>7。同一弱酸的正盐在相同条件下的水解程度大于酸式盐,Na2CO3是正盐,NaHCO3是酸式盐,Na2CO3溶液的pH大于NaHCO3溶液。酸越弱,对应盐的水解程度越大,溶液的碱性越强。HClO电离出H+的能力弱于H2CO3及HCO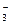
本题难度:一般
4、选择题 室温时,下列混合溶液的PH一定小于7的是
A.PH=3的盐酸和PH=11的氨水等体积混合
B.PH=3的盐酸和PH=11的氢氧化钡等体积混合
C.PH=3的醋酸和PH=11的氢氧化钡等体积混合
D.PH=3的硫酸和PH=11的氨水等体积混合
参考答案:C
本题解析:
试题分析:氨水是弱碱,所以pH=11的氨水浓度大于0.001mol/L,则A和D中氨水均过量,溶液显碱性,pH大于7;B中强酸强碱恰好反应,溶液显中性,pH=7;醋酸是弱酸,所以pH=3的醋酸浓度大于0.001mol/L,则C中醋酸过量,溶液显酸性,pH小于7,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题,试题灵活性强,侧重考查学生的灵活应变能力,有利于培养学生严谨的逻辑思维能力和灵活运用基础知识解决实际问题的能力。
本题难度:简单
5、选择题 .已知酸碱发生中和反应生成1molH2O时释放的热量称为中和热,强酸与强碱反应的中和热为57.3 kJ·mol–1。下列物质反应时,产生57.3 kJ热量的是
A.稀HCl和稀NaOH
B.1.0 mol·L-1 HCl和1.0 mol·L –1 NaOH
C.500 mL 2.0 mol·L-1 HCl和500 mL2.0 mol·L –1 NaOH
D.500 mL 2.0 mol·L-1 H2SO4和500 mL 2.0 mol·L-1 Ba(OH)2
参考答案:C
本题解析:考查中和热的概念及有关计算。A和B中没有指明参加反应的物质的物质的量,不正确。C中生成水是1mol,D中生成的水是2mol,放热为114.6kJ,所以答案是C。
本题难度:一般