微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某有色气体可能含NO2、CH4、CO2、HCl、NH3、Br2(g)等气体中的一种或几种,为确定其组成,进行以下操作:①通少许于水中,得无色溶液;②通少许于AgNO3溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶,导出的气体再通人澄清石灰水,产生浑浊。则可判断
A.一定存在NO2、Br2、HCl
B.一定不存在Br2、NH3、CH4
C.一定存在NO2、HCl、CO2
D.可能存在NH3、CH4
参考答案:C
本题解析:由①可判断,一定存在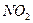 ;一定不存在
;一定不存在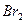 。由②可判断,一定存在HCl;一定不存在
。由②可判断,一定存在HCl;一定不存在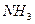 。由③、④可判断,一定存在HCI、
。由③、④可判断,一定存在HCI、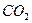 ;可能存在的是
;可能存在的是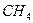 。
。
本题难度:一般
2、实验题 现有四瓶未知溶液它们是:NaCl(0.1mol/L)、NaOH(0.1mol/L)、HCl(0.1mol/L)、酚酞(0.1mol/L),某化学性质小组,为了将它们鉴别出来,而又没有其他任何试剂,于是同学们采取如下的实验步骤:
(1)将四瓶溶液用A、B、C、D标记
(2)取少许溶液两两混合,根据实验现象将四种物质分成两组
(3)取甲组混合液,不断滴入乙组中的一种未知液,可以鉴别出 A:??????????B:??????????
(4)再取已鉴别出的溶液2ml,滴入3滴C溶液,再滴加D溶液4ml,在整个过程中无明显的实验现象;可知C?????????D??????????(写化学式)写出上述实验过程中反应的离子方程式???????????????
参考答案:A :HCl、B:NaCl、C:酚酞、D :NaOH?? H
本题解析:四种溶液少许两两混合可产生两中不同的现象:NaOH溶液酚酞混合后溶液呈红色,NaCl和HCl混合溶液无色,向NaOH和酚酞的混合液中滴加HCl溶液,红色消失,而滴入NaOH时,无现象,从而可的出HCl和NaCl来。再取2ml0.1mol/l的盐酸,若先滴3滴0.1mol/lNaOH溶液,再滴加4ml酚酞则溶液变红色,因此检验出NaOH溶液和酚酞。
本题难度:简单
3、选择题 选择萃取剂将碘水中的碘萃取出来,该萃取剂应具备的性质是(???)
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
参考答案:B
本题解析:
试题分析:萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,选用的萃取剂的原则是:①和原溶液中的溶剂互不相溶更不能发生化学反应;②溶质在该溶剂中溶解度要远大于原溶剂,所以答案选B。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确萃取的实验原理以及萃取剂选择的依据,有利于培养学生规范严谨的实验设计能力,提高学生应试能力。
本题难度:简单
4、实验题 聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m, 广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是:________________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。

装置A中发生反应的化学方程式为_________________________________________。
(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_____________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。
参考答案:(1)将气体通入品红溶液,溶液退色,加热恢复原色(2分)
本题解析:
试题分析:(1)用品红溶液检验SO2气体(2)用浓硫酸干燥SO2,用向上排空法收集SO2;实验室用浓硫酸和铜反应制取SO2;(3)不引入新的杂质,可用铁屑将过量的稀硫酸除去(4)高锰酸钾具有强氧化性,故应用酸式滴定管盛放 (5)若溶液Z的pH偏小,将导致聚铁溶解,使铁的质量分数偏小。
本题难度:一般
5、填空题 氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
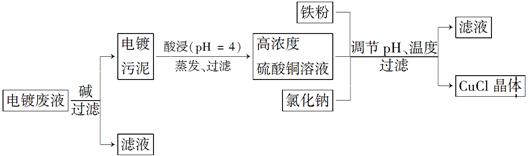
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
参考答案:(1)Cu(OH)2+2H+=Cu2++2H2O 3
本题解析:(1)酸浸后可得到高浓度的硫酸铜溶液,所以发生的反应为Cu(OH)2+2H+=Cu2++2H2O;由图像知当pH=3时CuCl的产率最高。(4)反应中加入了Na+,反应后生成了Fe2+,所以滤液成分为Na2SO4和FeSO4。(5)将铁粉换成Na2SO3,则为+4价S还原Cu2+。
点拨:本题考查化学与技术,考查考生对化学与技术的掌握情况。难度中等。
本题难度:困难