微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.4.6?g?Na完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1?NA(设NA表示阿伏加德罗常数的值)
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.在2Cu2S+2H2SO4+5O2═4CuSO4+2?H2O中,Cu2S发生还原反应
D.Al、Fe、Cu对应的氧化物均为碱性氧化物
参考答案:A
本题解析:分析:A.氧化钠和过氧化钠中阴阳离子个数比都是1:2,根据钠离子计算阴离子个数;
B.钠元素的焰色反应呈黄色,对钾元素的焰色反应造成干扰;
C.得电子化合价降低的反应物发生还原反应;
D.氧化铝是两性氧化物.
解答:A.氧化钠和过氧化钠中阴阳离子个数比都是1:2,4.6g钠的物质的量是0.2mol,4.6gNa完全转化成Na2O和Na2O2的混合物,钠离子的物质的量是0.2mol,所以生成物中阴离子总数为0.1?NA(设NA表示阿伏加德罗常数的值),故A正确;
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液可能是钠盐溶液,也可能是钾盐溶液,要确定是否是钾盐溶液,要透过蓝色的钴玻璃滤去黄光的干扰,故B错误;
C.该反应中,Cu2S的铜、硫元素都失电子发生氧化反应,故C错误;
D.铁、铜的氧化物是碱性氧化物,氧化铝既能和酸反应又能和强碱反应,所以是两性氧化物,故D错误;
故选A.
点评:本题考查了物质的构成、焰色反应、氧化还原反应等知识点,知道焰色反应的操作方法,明确过氧化钠中阴离子是过氧根离子而不是氧离子,为易错点.
本题难度:简单
2、填空题 (1)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知: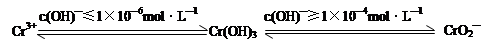
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式???????????????????????????????。
②完成用离子方程式表示溶液pH不能超过10(即c(OH)—≥1×10—4mol·L—1)的原因为Cr(OH)3 + OH-=????????+2H2O。
(2)在硝酸工业生产吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,完成反应方程式:NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2????,该反应中能用纯碱代替氢氧化钠溶液发生反应的原因是利用了Na2CO3水解呈现的?????性。
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量?随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,完成有关反应的离子方程式为:
___________+3OH-=Al(OH)3↓+2F-;__________+3OH-=Al(OH)3↓+3F-。

?
参考答案:(12分)(1)①Cr2O72-+6Fe2++14H+=2C
本题解析:
试题分析:(1)①Cr2O72—具有氧化性,能把硫酸亚铁氧化生成硫酸铁,所以Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
②根据已知信息可知,溶液pH不能超过10时氢氧化铬会溶解在强碱中生成CrO2—,即反应的离子方程式为Cr(OH)3 +OH-=CrO2—+2H2O。
(2)根据原子守恒可知,另外一种生成物是CO2,所以反应的化学方程式为NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2
本题难度:一般
3、选择题 某溶液中含有下列六种离子:①HCO3-?②SO32-?③Na+?④CO32-?⑤NH4+?⑥NO3-,向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是
A.只有⑥
B.④⑥
C.③④⑥
D.①②⑤
参考答案:A
本题解析:
试题分析:Na2O2具有氧化性,能氧化②SO32?, Na2O2与水反应生成NaOH,与①HCO3-⑤NH4+反应,生成④CO32-,所以浓度基本保持不变的是⑥。
本题难度:一般
4、选择题 在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是(??? )

A.a→b时的沉淀的成分为BaSO4与Mg(OH)2
B.b→c时发生的离子反应为:H+ + OH— → H2O
C.c→d时离子的物质的量:Ba2+可能大于Cl—
D.d→e时离子的物质的量:Ba2+一定大于OH—
参考答案:B
本题解析:
试题分析:往混合溶液中加Ba(OH)2溶液,开始阶段发生的反应为Ba2++SO42- +2H+ + 2OH— = BaSO4↓+ 2H2O,图像为a-b段;当SO42- 被完全沉淀时,还有2mol H+?,所以继续滴加Ba(OH)2溶液,发生的反应为H+ + OH— = H2O,无沉淀产生,图像为b-c段,该阶段消耗Ba(OH)2 1mol;再继续滴加Ba(OH)2溶液,发生反应为Mg2++ 2OH— = Mg(OH)2↓,所以沉淀有增多,图像为c-d段,当镁离子完全被沉淀,则沉淀不再增多,图像保
本题难度:一般
5、实验题 下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
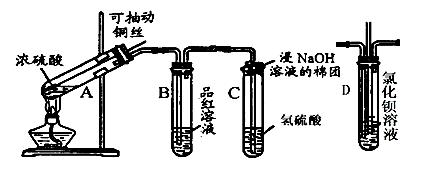
(1)?????试管C口部的棉团上发生反应的离子方程式是????????????????????????????。
(2)?????反应一段时间后,将B试管中的溶液加热,可以观察到???????????????????????。试管C中溶液变浑浊,则证明SO2具有??????????????性。
(3)?????试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是?????????????,如果浸NaHCO3溶液,则发生反应的离子方程式是??????????????????????????。
(4)?????如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是?????????、?????????、?????????、?????????(要求填二种化合物和二种单质的化学式)。
(5)?????取下C试管,试管中溶液浑浊,煮沸后,再加入Na2S溶液并加热,溶液变澄清,经测定溶液中主要存在一种摩尔质量为128g/mol的二价阴离子(反应①)。向该澄清液中加入氯水,溶液仍然澄清(反应②),加入氯化钡可得一种不溶于稀盐酸的白色沉淀,写出反应①和反应②的离子方程式?????,????????????。
参考答案:(1)SO2 +2OH-=SO32-+H2O (或SO2 +
本题解析:略
本题难度:一般