微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
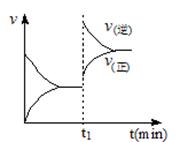
A.2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
C.H2(g)+I2(g) 2HI(g) △H>0
2HI(g) △H>0
D.C(s)+H2O(g) CO(g)+H2(g) △H>0
CO(g)+H2(g) △H>0
参考答案:B
本题解析:
试题分析:由图可知,改变一个条件后,平衡逆向移动,且反应速率加快。若是升高温度,则逆向是吸热反应,正向则是放热反应;若是增大压强,则逆向是气体的物质的量减小的方向,正向则是气体物质的量增大的方向,据此判断正向是放热且气体的物质的量增大的可逆反应符合此图,所以答案选B。
考点:考查对平衡图像的分析,化学平衡的移动理论的应用
本题难度:一般
2、选择题 高温下,反应2HBr(g)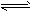 H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是 [???? ]
H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是 [???? ]
A、减小压强
B、缩小体积
C、降低温度
D、增大氢气的浓度
参考答案:B
本题解析:
本题难度:一般
3、填空题 铁元素及其化合物与人类的生产生活息息相关,回答下列问题
(1)铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+.
①铁酸钠中铁元素的化合价为______.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:______.(用离子方程式表示)
(2)反应ⅠFe(s)+CO2(g)?FeO(s)+CO(g)△H=a?kJ?mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g)△H=b?kJ?mol-1测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900
K
1.00
1.47
2.40
①写出反应Ⅰ的K的表达式______.
②反应Ⅰ中的a______0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO2起始浓度为2mol?L-1,CO的平衡浓度为______mol?L-1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有______(填序号).
A.缩小反应器体积??????????????????????????B.通入CO2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=______kJ?mol-1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL?5mol?L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______g.
参考答案:(1)①令铁酸钠(Na2FeO4)中铁元素的化合价为n,则1
本题解析:
本题难度:一般
4、选择题 如图装置的水溶液中存在如下平衡:AsO33-+H2O+I2 AsO43-+2H++2I-,往上层溶液中滴入足量试剂X充分振荡,静置后下层液体变无色。则X可能是 AsO43-+2H++2I-,往上层溶液中滴入足量试剂X充分振荡,静置后下层液体变无色。则X可能是
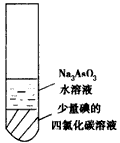 [???? ] [???? ]
A.溴水
B.氯化铁溶液
C.碳酸氢钠溶液
D.稀硫酸
参考答案:C
本题解析:
本题难度:一般
5、选择题 反应:A(g)+3B(g)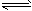 2C(g);△H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是 [???? ] 2C(g);△H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是 [???? ]
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
参考答案:C
本题解析:
本题难度:一般
|