微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃
| 700
| 900
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
回答下列问题:
(1)该反应的 △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率会 (填“变大”、“变小”或“不变”)
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。 A(g)+B(g)的平衡常数的值为 。
2、选择题 下列叙述正确的是
A.KSp[MgF2]>KSp[Mg(OH)2],不能实现Mg(OH)2转化为MgF2。
B.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深
3、选择题 合成氨所需H2可由煤和水反应制得,其中一步反应为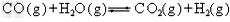 (正反应是放热反应),欲提高CO的转化率可采用的方法有:①减小压强;②降低温度;③增大水蒸气的浓度;④增大CO的浓度;⑤使用催化剂,其中正确的组合是 [???? ] (正反应是放热反应),欲提高CO的转化率可采用的方法有:①减小压强;②降低温度;③增大水蒸气的浓度;④增大CO的浓度;⑤使用催化剂,其中正确的组合是 [???? ]
A、②④????
B、②③?????
C、①⑤???
D、只有③
4、填空题 研究NO2.SO2.CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g) 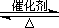 2SO3(g) ?H=-196.6 kJ·mol-1 2SO3(g) ?H=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H=-113.0 kJ·mol-1 2NO2(g) ?H=-113.0 kJ·mol-1
(
5、填空题 一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为: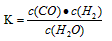
(1)写出该反应的化学方程式:____________________;
(2)能判断该反应一定达到化学平衡状态的依据是____________(填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化
B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化
D. 容器中总的物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
(1)t1~t2这段时间内的化学反应速率v(H2)=____________。
(2)若继续加入2 mol Fe(s),则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是____________、____________。(填写2项)

|