微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)Ⅰ.(1)饱和氯化铵溶液显酸性,原因是
________________________________________________________________________
________________________________________________________________________;
向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解;其合理的解释(用相关离子方程式表示)为
________________________________________________________________________
________________________________________________________________________。
(2)向Mg(OH)2悬浊液中加入适量CH3COONH4溶液,
Mg(OH)2能否完全溶解________(填“能”或“否”),理由是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4===H++HSO4-,HSO4-===H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”“中性”或“弱碱性”),其理由是________________________________________________________________________
(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式________________;
(5)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO2-4)=0.029 mol·L-1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”“>”或“=”),其理由是________________________________________________________________________;
(6)如果25℃时,0.10 mol·L-1H2SO4溶液的pH=
-lg 0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)=________mol·L-1。
参考答案:Ⅰ.(1)NH4++H2O??NH3·H2O+H+
M
本题解析:Ⅰ.此题探究Mg(OH)2溶解的原理,促进溶解平衡右移,一是降低c(Mg2+),二是降低c(OH-)。
Ⅱ.以信息题形式说明HSO4-的电离是不完全电离,说明其是弱根类同HCO3-作答。
本题难度:一般
2、选择题 下列叙述正确的是(???)
A.浓度均为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,
则:c(CH3COO-)<c(CH3COOH)
B.浓度均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-) + c(NH3·H2O)
C.浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合:c(Na+)+ c(H+)= c(CO32-)+ c(OH-) + c(HCO3-)
D.用pH=3的盐酸滴定10 mL pH=11的氨水,达到滴定终点用去盐酸的体积小于10 mL
参考答案:B
本题解析:
试题分析:浓度均为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,说明醋酸的电离大于水解,所以c(CH3COO-)>c(CH3COOH),故A错误;浓度均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中,根据质子守恒,可以得到c(H+)=c(OH-) + c(NH3·H2O),故B正确;浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合得到浓度为0.05mol·L-1的碳酸钠溶液,在该溶液中,根据电荷守恒可以得到c(Na+)+ c(
本题难度:简单
3、选择题 下列过程或现象与盐类水解无关的是???(???)
A.纯碱溶液加热可增加去污效果
B.在潮湿的环境下铁片表面形成红棕色水膜
C.氯化铁饱和溶液滴入沸水中形成胶体
D.NaHCO3与Al2(SO4)3可作为泡沫灭火器的反应药剂
参考答案:B
本题解析:
试题分析:加热促进CO32-水解,A正确;潮湿环境下铁生锈,是因为发生了原电池反应,B错误;加热、增大氯化铁浓度促进氯化铁水解,C正确;Al3+与HCO3-发生双水解反应生成二氧化碳,D正确。
点评:铁表面形成铁锈的原理是潮湿环境中形成原电池,电池反应为2Fe+O2+2H2O=2Fe(OH)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3、Fe(OH)3失水形成Fe2O3·xH2O。
本题难度:一般
4、选择题 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO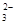 )、c(HCO3?)都减少,其方法是(???)
)、c(HCO3?)都减少,其方法是(???)
A.加入氢氧化钠固体
B.加水
C.通入二氧化碳气体
D.加入饱和石灰水溶液
参考答案:D
本题解析:略
本题难度:一般
5、选择题 将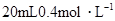 硝酸铵溶液跟
硝酸铵溶液跟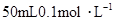 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
A.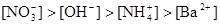
B.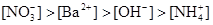
C.
D.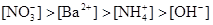
参考答案:B
本题解析:NH4NO3的物质的量为:0.02×0.4=0.008mol,Ba(OH)2的物质的量为:0.05×0.1=0.005mol,OH-为0.01mol。首先两溶液混合要考虑下列反应:NH4++OH-=NH3·H2O,OH-剩余0.002mol。由上述分析可得: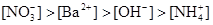 ,答案选B。
,答案选B。
本题难度:一般