微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组比较不正确的是(???)
A.熔点:Li>Na>K
B.碱性:LiOH>NaOH>KOH
C.还原性:K >Na>Li
D.氧化性:Cs+>Rb+>K+
参考答案:BD
本题解析:碱金属从Li到Cs熔点逐渐降低,单质还原性递增,相应的阳离子的氧化性递减,对应的碱的碱性增强。
本题难度:简单
2、填空题 海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
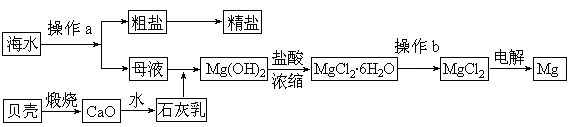
回答下列问题:
(1)流程图中操作a的名称为??????????????。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①已知气体A、B是CO2或NH3,则气体A应是???????(填化学式)。
②灼烧晶体C的反应方程式为?????????????????????????????????。
③滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却后,可析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是???????????。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
① 若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:??????????????????????。
② 通过操作b获得无水MgCl2是在?????????????氛围中进行,若直接在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式:???????????????????。
参考答案:(1)蒸发结晶(或蒸发)………(2分)
(2)①NH
本题解析:
试题分析:(1)由流程图可知是从海水中分离出粗盐,即从溶液中分离出溶质,故用蒸发结晶的方法。
(2)①由于二氧化碳在水中的溶解度很小,而氨气极易溶于水,溶液显碱性,所以制取碳酸氢钠的方法是向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,因此A是氨气。
②C是碳酸氢钠,不稳定加热易分解生成碳酸钠、二氧化碳和水,所以灼烧晶体C的反应方程式为2NaHCO3 本题难度:困难
本题难度:困难
3、计算题 将m g固体NaHCO3加热分解一段时间后,质量变为n g。试求:
(1)尚未分解的NaHCO3的质量;
(2)生成的Na2CO3的质量;
(3)NaHCO3完全分解时的n值。
参考答案:(1) 本题解析:本题可用“差量法”解题。反应前固体为NaHCO3,反应后为未反应的NaHCO3和反应生成的Na2CO3的混合物。因此找到反应物Na2CO3和反应前后固体质量差对应的正比例关系即可迅速解题。
本题解析:本题可用“差量法”解题。反应前固体为NaHCO3,反应后为未反应的NaHCO3和反应生成的Na2CO3的混合物。因此找到反应物Na2CO3和反应前后固体质量差对应的正比例关系即可迅速解题。
(1)2NaHCO3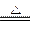 Na2CO3+H2O↑+CO2↑ Δm
Na2CO3+H2O↑+CO2↑ Δm
168 g??????? 106 g??????
本题难度:简单
4、填空题 将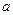 g金属钠投入到
g金属钠投入到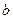 g水(足量)中。
g水(足量)中。
(1)所得溶液中溶质的质量分数为 ;
(2)能否求溶液中溶质的物质的量浓度?为什么?
????????????????????????????????????????????????????????????????? ??????;
??????;
(3)所得溶液中Na+与H2O的个数比为 。
参考答案:(1)40a/(22a+23b);
(2)不能,因为不
本题解析:略
本题难度:一般
5、填空题 如右图所示装置用于测定某碱金属的相对原子质量。仪器本身连同水和干燥管以及其内的无水氯化钙的总质量为480.00 g。现将1.46 g某碱金属单质投入水中,立即用带有干燥管的塞子塞紧瓶口,反应完毕后,测得整套仪器的总质量为481.25 g。该金属元素的相对原子质量是________(结果保留两位小数),若不用干燥管,测得的相对原子质量比实际相对原子质量________(填“偏大”“偏小”或“相等”),理由是________________________________。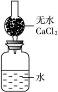
参考答案:6.95?偏小?水蒸气随氢气带出,使测得的H2的质量比实际质
本题解析:根据?
2M+2H2O====2MOH+H2↑??Δm
2Ar g?????????????? 2 g??? (2Ar-2) g
1.46 g?????????????????? (481.25-480.00) g
则有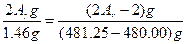
则Ar=6.95
本题难度:简单