微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应:A2(?)+B2(?) 2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是
2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是

A. A2、B2及AB均为气体,Q>0
B.AB为气体,A2、B2至少有一种为非气体,Q>0
C.AB为气体,A2、B2有一种为非气体,Q<0
D.AB为固体,A2、B2有一种为非气体,Q>0
参考答案:B
本题解析:根据图像可知,温度越高,物质AB的物质的量减少,这说明升高温度,平衡向逆反应方向进行,即正反应是放热反应,使用Q大于0;增大压强时物质AB的物质的量也减少,这说明增大压强,平衡向逆反应方向进行,因此正反应是体积增大的,所以AB一定是气体,而反应物A2、B2中至少有一种为非气体,所以答案选B。
本题难度:一般
2、填空题 在恒温下,将a mol N2与b mol H2的混合气体通入一个体积为V L固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1) 若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量__________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)
n(始)∶n(平)= __________。
(4)原混合气体中a∶b=__________。
(5) 达到平衡时,N2和H2的转化率之比α (N2)∶α (H2)= __________。
(6) 若反应达平衡用时为10分钟,用NH3表示从反应开始到平衡的化学反应速率 __________。
参考答案:⑴ 16mol?????⑵??? 8 mol????????
本题解析:
试题分析:(1)根据方程式N2(g)+3H2(g)  2NH3(g)可知,反应进行到某时刻t时,生成了nt(NH3)=6mol,则参加反应的nt(N2)=6÷2mol=3mol,则a=13+3=16mol。
2NH3(g)可知,反应进行到某时刻t时,生成了nt(NH3)=6mol,则参加反应的nt(N2)=6÷2mol=3mol,则a=13+3=16mol。
(2)NH3的含量(体积分数)为25%,则V(NH3)=716.8L×0.25=179.2L,所以标准状况下n(NH3)=179.2L÷22.4L、mol=8mol。
(3)第二问已经算出n(NH3)=8mol,混合气体的总的物质的量为716.8L÷22.4L/mol=32mol。根据方程式可以算出参与反应的N2=4mol,H2=12mol,则反应前混合气体的物质的量=4+12+32×75%=40mol,所以n(始):n(平)= 40:32=5:4。
(4)第三问已经算出反应前总的物质的量为40mol,a=16mol,则b=40-16=24mol,即a:b=16:24=2:3。(5)a(N2)=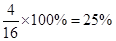 ,a(H2)=
,a(H2)= 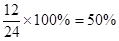 ,则a(N2):a(H2)=0.25:0.5=1:2。
,则a(N2):a(H2)=0.25:0.5=1:2。
(6)氨气的反应速率是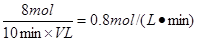 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的规范答题能力和逻辑推理能力。
本题难度:一般
3、选择题 高炉炼铁的主要反应是:Fe2O3+3CO 2Fe +3CO2。下列说法正确的是(??)
2Fe +3CO2。下列说法正确的是(??)
A.CO2的电子式为
B.Fe2O3分别与浓硝酸和稀硝酸反应,二者产物不同
C.在高炉炼铁过程中,若增加炼铁高炉的高度能提高CO的转化率
D.在高炉炼铁过程中,将铁矿石粉碎后投入高炉可以提高该反应的化学反应速率
参考答案:D
本题解析:A不正确,应该是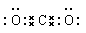 。B不正确,产物都是硝酸铁和水。C不正确,增加炼铁高炉的高度不能提高CO的转化率,增大反应物的接触面积,可以加快反应速率,D正确,答案选D。
。B不正确,产物都是硝酸铁和水。C不正确,增加炼铁高炉的高度不能提高CO的转化率,增大反应物的接触面积,可以加快反应速率,D正确,答案选D。
本题难度:一般
4、填空题 (13分)煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1
①下列措施中,不能提高碳的转化率的是??????(填字母序号)。
a.容器的容积不变,增加水蒸汽的物质的量
b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走
d.其他条件不变,升高温度
②又知,C(s)+CO2(g) 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为??????。
CO2(g)+H2(g)的焓变(△H)为??????。
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2 CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
 ???????①a处通入的是?????(填物质名称),左侧电极上发
???????①a处通入的是?????(填物质名称),左侧电极上发
生?????(填“氧化”或“还原”)反应。
②该电池工作过程中,H+的移动方向为从??????到
????(填“左”或“右”)
③该电池正极反应式为???????????。
④若用该电池提供的电能电解60mL NaCl溶液,设有
0.01molCH3OH完全放电,NaCl足量,且电解产生的
Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=??????。
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应,
CO(g)+H2O(g) CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
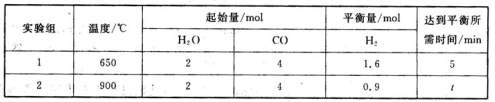
①在实验1中,以v(CO2)表示该反应的反应速率为??????mol·L-1·min-1;
②在实验2中,t???????5。(填“>”、“<”或“=”)
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
5、选择题 下列有关反应限度的说法错误的是
A.某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关
B.炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.可逆反应的限度不随反应条件的改变而改变
参考答案:D
本题解析:
试题分析:A.某条件下可逆反应达到限度之前,反应从正反应方向开始,逆反应速率逐渐增大,就是由于反应物不断反应变为生成物,使生成物浓度逐渐增大。物质的浓度越大,反应速率也就越快。正确。B.在炼铁高炉中发生的CO还原氧化铁的反应是可逆反应。当反应达到该条件下的反应限度时,无论高炉高度改变与否,尾气中CO含量不随而改变。正确。C.当化学反应达到该条件下的化学反应的限度时,各种反应物也就得到了在该条件下的最大转化率,因此化学反应的限度决定了反应物在该条件下的最大转化率。正确。D.可逆反应的限度是在一定条件下的限度。若外界条件发生改变,则平衡被破坏,就会达到新的条件下的新的限度,因此会随反应条件的改变而改变。错误。
本题难度:一般