微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某同学为试验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液.观察到如下现象:①CuS不溶于醋酸溶液;②CuS不溶于浓盐酸;③CuS不溶于浓硫酸;④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生.根据上述现象,该同学得出了以下结论,其中正确的是( )
A.CuS不溶于弱酸,能溶于强酸
B.CuS不溶于非氧化性酸,能溶于氧化性酸
C.CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使溶解沉淀平衡往溶解方向移动
D.CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使溶解沉淀平衡往溶解方向移动
2、选择题 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A.图中a点对应的是AgBr的不饱和溶液
B.在t℃时, Ksp(AgBr) =4.9×10-13
C.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
D.在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到c点
3、选择题 常温时,Ksp[Mg(OH)2] = 1.1×10-11,Ksp(AgCl) = 1.8×10-10,Ksp(Ag2CrO4) = 1.9×10-12,Ksp(CH3COOAg) = 2.3×10-3,下列叙述不正确的是
A.浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀
C.c(Mg2+)为0.11 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
4、填空题 (11分)电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是__________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
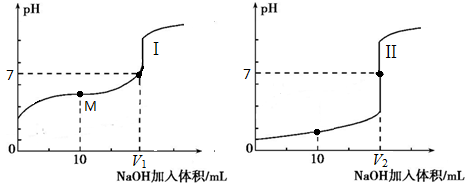
①滴定醋酸的曲线是_____(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____。
③V1和V2的关系:V1_____V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤
| 现象
|
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。
| 出现白色沉淀。
|
步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。
| 溶液变红色。
|
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。
| 现象a,溶液红色变浅。
|
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。
| 出现黄色沉淀。
①写出步骤2中溶液变红色的离子方程式__________________。
②步骤3中现象a是_____________________。
③用化学平衡原理解释步骤4的实验现象______________________。
5、实验题 (14分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
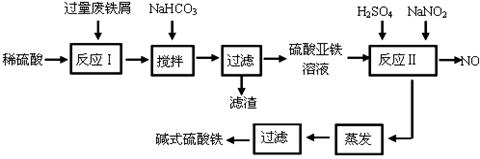
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
| 开始沉淀
| 2.3
| 7.5
| 3.4
| 完全沉淀
| 3.2
| 9. 7
| 4.4
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为 。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将
会 (填“偏高” “偏低” “不变”)
|
|