微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某同学为试验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液.观察到如下现象:①CuS不溶于醋酸溶液;②CuS不溶于浓盐酸;③CuS不溶于浓硫酸;④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生.根据上述现象,该同学得出了以下结论,其中正确的是( )
A.CuS不溶于弱酸,能溶于强酸
B.CuS不溶于非氧化性酸,能溶于氧化性酸
C.CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使溶解沉淀平衡往溶解方向移动
D.CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使溶解沉淀平衡往溶解方向移动
参考答案:A、CuS不溶于浓硫酸,在浓硝酸中溶解,可以知到硫化铜在强酸
本题解析:
本题难度:一般
2、选择题 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A.图中a点对应的是AgBr的不饱和溶液
B.在t℃时, Ksp(AgBr) =4.9×10-13
C.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
D.在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到c点
参考答案:D
本题解析:
试题分析:根据图示可知:在线上的点,为饱和溶液,在线作下方的点溶液未达到饱和,在线右上方的点是过饱和溶液。A.图中a点在线的左下方,由于c(Br-)·c(Ag+)<Ksp(AgBr)=4.9×10-13,所以对应的是AgBr的不饱和溶液,正确;B.在t℃时, Ksp(AgBr) = c(Br-)·c(Ag+)=4.9×10-13,正确;C. t℃时AgCl的Ksp=4×10-10,c(Cl-)= c(Ag+)=2×10-5,Ksp(AgBr) = c(Br-)·c(Ag+)=4.9×10-13,则AgCl(s)+ Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K= c(Cl-)÷c(Br-)=Ksp(AgCl)÷Ksp(AgBr)= 4×10-10÷4.9×10-13≈816,正确;D.在AgBr的饱和溶液中加入NaBr固体,沉淀溶解平衡仍然存在,由于c(Br-)增大,所以平衡逆向移动,c(Ag+)减小,但是二者的乘积不变,只能是线上的点,溶液不可能由b点到c点,错误。
AgBr(s)+Cl-(aq)的平衡常数K= c(Cl-)÷c(Br-)=Ksp(AgCl)÷Ksp(AgBr)= 4×10-10÷4.9×10-13≈816,正确;D.在AgBr的饱和溶液中加入NaBr固体,沉淀溶解平衡仍然存在,由于c(Br-)增大,所以平衡逆向移动,c(Ag+)减小,但是二者的乘积不变,只能是线上的点,溶液不可能由b点到c点,错误。
考点:考查图像法在表示沉淀溶解平衡及溶液中离子浓度、溶液的饱和程度的应用的知识。
本题难度:一般
3、选择题 常温时,Ksp[Mg(OH)2] = 1.1×10-11,Ksp(AgCl) = 1.8×10-10,Ksp(Ag2CrO4) = 1.9×10-12,Ksp(CH3COOAg) = 2.3×10-3,下列叙述不正确的是
A.浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀
C.c(Mg2+)为0.11 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
参考答案:B
本题解析:
试题分析:A、浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合,c(Ag+)?c(CH3COO?)=0.1×0.1=0.01>Ksp(CH3COOAg),所以一定产生CH3COOAg沉淀,正确;B、根据Ksp(AgCl) 和Ksp(Ag2CrO4)求出形成AgCl、Ag2CrO4沉淀时的Ag+浓度,可知形成Ag2CrO4沉淀Ag+浓度浓度大,所以先产生AgCl沉淀,错误;C、c(OH?)2?c(Mg2+)=Ksp[Mg(OH)2],可得c(OH?)=10-5mo
本题难度:一般
4、填空题 (11分)电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是__________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
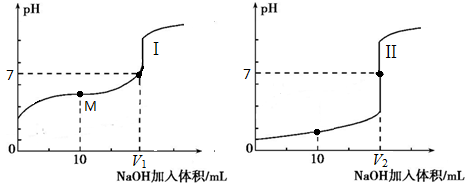
①滴定醋酸的曲线是_____(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____。
③V1和V2的关系:V1_____V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤
| 现象
|
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。
| 出现白色沉淀。
|
步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。
| 溶液变红色。
|
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。
| 现象a,溶液红色变浅。
|
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。
| 出现黄色沉淀。
①写出步骤2中溶液变红色的离子方程式__________________。
②步骤3中现象a是_____________________。
③用化学平衡原理解释步骤4的实验现象______________________。
参考答案:(13分,未标分数的空,每空1分) (1)① CH3COOH
本题解析:
试题分析:(1)①醋酸是一元弱酸,在溶液中存在电离平衡,则醋酸在水溶液中的电离方程式为CH3COOH CH3COO-+H+。 CH3COO-+H+。
②a.滴加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,电离程度减小,a错误;b.电离吸热,微热溶液促进电离,电离程度增大,b正确;c.加水稀释粗电离,电离程度增大,c正确;d.加入少量醋酸钠晶体,增大醋酸根浓度,抑制醋酸电离,电离程度减小,bc。
(2)①醋酸是弱酸,0.1mol/L醋酸溶液的pH大于1,则滴定醋酸的曲线是I。
②盐酸和氢氧化钠溶液均是一元的强酸和强碱,在浓度相等的条件下对水的电离程度影响是相同的。醋酸是一元弱酸,在浓度与盐酸相等的条件下,溶液中氢离子浓度小,对水的电离程度影响小于盐酸,则滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol/L醋酸。
③氢氧化钠和醋酸恰好反应时生成的醋酸钠水解溶液显碱性,要满足溶液显中性,则醋酸应该过量。而氢氧化钠与盐酸恰好反应时生成的氯化钠不水解,溶液显中性,所以V1小于V2。
④M点时醋酸过量,溶液是由等浓度的醋酸钠和醋酸构成的,溶液显酸性,则对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)> c (Na+)> c (H+)> c (OH-)。
(3)① 铁离子与KSCN溶液反应使溶液显红色,反应的离子方程式为Fe3++3SCN- Fe(SCN)3。 Fe(SCN)3。
②硝酸银溶液能与KSCN溶液反应产生白色沉淀,所以向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液时溶液中仍然会出现白色沉淀。
③根据以上分析可知溶液中存在平衡AgSCN(s) Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,因此Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,从而导致AgSCN的溶解平衡正向移动。 Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,因此Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,从而导致AgSCN的溶解平衡正向移动。
考点:考查弱电解质的电离平衡、盐类水解以及溶解平衡等
本题难度:一般
5、实验题 (14分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
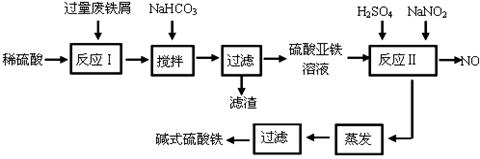
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
| 开始沉淀
| 2.3
| 7.5
| 3.4
| 完全沉淀
| 3.2
| 9. 7
| 4.4
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为 。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将
会 (填“偏高” “偏低” “不变”)
参考答案:(共14分)(1)4.4~7.5 (2分)
本题解析:
试题分析:(1)根据流程图分析,加入碳酸氢钠的目的是与铝离子发生双水解反应使铝离子完全沉淀,而亚铁离子不能沉淀,所以溶液的pH为4.4~7.5之间;
(2)加入亚硝酸钠的目的是氧化亚铁离子为铁离子,同时亚硝酸根离子被还原为NO,离子方程式是2H+ + Fe2++ NO2- = Fe3+ + NO↑ + H2O;
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,使溶液呈酸性,所以水解的离子方程式是2Fe(OH)2+ +2H2O Fe2(OH)42+ + 2H+; Fe2(OH)42+ + 2H+;
(4)因为产品中含有铁离子和亚铁离子,所以验证是否含有亚铁离子不能选择氯水、KSCN溶液、氢氧化钠溶液,只能选择高锰酸钾溶液,因为亚铁离子与高锰酸钾溶液发生氧化还原反应而使之褪色,所以答案选D;
(5)加入过氧化氢将亚铁离子氧化为铁离子,铁离子与碘离子反应生成的碘单质用Na2S2O3标准溶液滴定,根据2Na2S2O3~I2~2Fe3+,可知铁元素的质量是0.1000 mol·L-1×0.02L×56g/mol=0.112g,则溶液中铁元素的总含量为0.112g/0.02L=5.6g/L;若过氧化氢没有除尽,则过氧化氢也会氧化碘离子为碘单质,消耗的Na2S2O3标准溶液的体积偏多,所以测定的结果偏高。
考点:考查工业流程的分析,滴定实验的计算,离子的检验,离子方程式的书写,误差的分析
本题难度:困难
|
|