微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各碱溶液,当其pH相同时,物质的量浓度最大的是
A.KOH
B.NH3·H2O
C.Ba(OH)2
D.NaOH
参考答案:B
本题解析:略
本题难度:一般
2、选择题 能使水的电离平衡右移,且水溶液显酸性的微粒是( ? )
A.Al3+
B.OH-
C.H+
D.HCO3-
参考答案:A
本题解析:
本题难度:简单
3、选择题 25℃时,水的电离平衡:H2O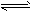 H++OH- △H>0,下列叙述正确的是[???? ]
H++OH- △H>0,下列叙述正确的是[???? ]
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,c(H+)不变,pH不变
参考答案:B
本题解析:
本题难度:一般
4、填空题 已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= 。
(2)HA的电离平衡常数K= ;
(3)升高温度时,K (填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的 倍。
参考答案:(1)1.0×10-4 mol/L
(2)1×10-
本题解析:(1)HA电离出的c(H+)=0.1×0.1% mol/L=1×10-4 mol/L;
(2)电离平衡常数
K=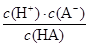 =
= =1×10-7;
=1×10-7;
(3)因HA的电离是吸热过程,升高温度c(H+)、c(A-)均增大,则K增大;
(4)c(H+)HA=1×10-4 mol/L,c(H+)水=c(OH-)=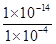 =1×10-10 mol/L,所以c(H+)HA∶c(H+)水=(1×10-4)∶(1×10-10)=106。
=1×10-10 mol/L,所以c(H+)HA∶c(H+)水=(1×10-4)∶(1×10-10)=106。
本题难度:一般
5、选择题 25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba(OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 [???? ]
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
参考答案:A
本题解析:
本题难度:一般