微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1) 实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的燃烧热ΔH= 。
(2)今有如下两个热化学方程式:
参考答案:
本题解析:
本题难度:一般
2、填空题 捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)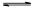 (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)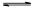 (NH4)2HCO3(aq) △H2
(NH4)2HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)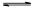 2(NH4)2HCO3(aq) △H3
2(NH4)2HCO3(aq) △H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3 。
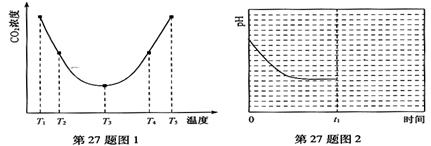
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3 0(填>、=或<)。
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,
其原因是 。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度上升到T2,并维持该温度。请在图中画出t1时刻后溶液的pH变化总趋势曲线。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是 。
A.NH4Cl
B.Na2CO3
C.HOCH2CH2OH
D.HOCH2CH2NH2
参考答案:
(1)2△H2-△H1&
本题解析:
(1)将反应Ⅰ倒过来书写:
(NH4)2CO3 (aq) 2NH3 (l)+ H2O (l)+ CO2 (g) —△H1
2NH3 (l)+ H2O (l)+ CO2 (g) —△H1
将反应Ⅱ×2:
2NH3 (l)+ 2H2O (l)+ 2CO2 (g) 2NH4HCO3 (aq) 2△H2
2NH4HCO3 (aq) 2△H2
得:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g) 2NH4HCO3 (aq) △H3 =2△H2—△H1
2NH4HCO3 (aq) △H3 =2△H2—△H1
(2)由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H3<0)。在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小。反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡。
(3)根据平衡移动原理,降低温度或增大c(CO2)
(4)具有碱性的物质均能捕获CO2,反应如下:Na2CO3 +CO2 +H2O=2NaHCO3;HOCH2CH2NH2 +CO2 +H2O= HOCH2CH2NH3+ HCO3—。
【考点定位】考查热化学方程式书写,化学反应速率、化学平衡移动和化学方程式书写等。
本题难度:困难
3、填空题 (8分).2009年10月16日第十一届全运会在济南举行,全运会使用的火炬的燃料是丙烷。
(1)已知11g丙烷完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则该溶液中由水电离出的c(OH-)为
参考答案:(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O
本题解析:略
本题难度:一般
4、选择题 一定条件下的密闭容器中:4NH3(g)+5O2(g)

4NO(g)+6H2O(g)△H=-905.9kJ?mol-1,下列叙述正确的是( )
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时v正(O2)=
4
5
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
参考答案:D
本题解析:
本题难度:简单
5、选择题 N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
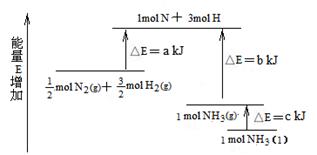
A.N2(g)+3H2(g) = 2NH3(g) ;△H = 2(b—a) kJ/mol
B.N2(g)+3H2(g) = 2NH3(l);△H = 2(a—b—c) kJ/mol
C.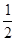 N2(g)+ N2(g)+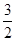 H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol
D.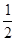 N2(g)+ N2(g)+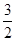 H2(g) =NH3(g) ;△H = (a+b) kJ/mol H2(g) =NH3(g) ;△H = (a+b) kJ/mol
参考答案:B
本题解析:
试题分析:由图示可知:断裂1/2mol N2(g)和3/2mol H2(g)中的化学键共吸收akJ的能量,由1 mol N和3 mol H生成1 mol NH3(g)放出bkJ的能量,由1 mol NH3(g)变为1 mol NH3(l)放出ckJ能量,故有①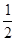 N2(g)+ N2(g)+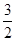 H2(g) = NH3(l) ;△H =(a—b—c) kJ/mol;①式乘以2得:②N2(g)+3H2(g) H2(g) = NH3(l) ;△H =(a—b—c) kJ/mol;①式乘以2得:②N2(g)+3H2(g) 2NH3(g) ΔH= 2(a-b-c)kJ·mol-1,选B。 2NH3(g) ΔH= 2(a-b-c)kJ·mol-1,选B。
考点:考查反应热的计算,盖斯定律的应用。
本题难度:困难
|