微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为 __KClO3+__HCl(浓)——__KCl+__ClO2↑+___Cl2↑+___H2O
(1)配平上述化学方程式并用双线桥标出电子转移的方向和数目。
(2)氧化剂是________,还原剂是________;氧化产物是________,还原产物是________。
(3)浓盐酸在反应中显示出来的性质是________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)产生0.1mol Cl2,则转移的电子的物质的量为________mol。
参考答案:18.
(1) 本题解析:
本题解析:
试题分析:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2.电子转移的方向和数目为:
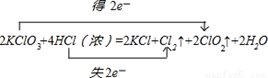
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半.选:②.
(3))KClO3中氯元素化合价由+5价降低为ClO2中+4价,HCl中氯元素化合价由-1价升高为Cl2中0价,氧化剂是KClO3,还原剂是HCl;氧化产物是Cl2,还原产物是ClO2。
(4)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol.答案为:0.2mol.
考点:考查氧化还原反应的基本概念与配平。
本题难度:一般
2、选择题 下列化学用语正确的是(???)
①Na+的结构示意图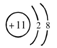 ????????????????????????????????②乙酸的分子式:CH3COOH
????????????????????????????????②乙酸的分子式:CH3COOH
③HC1O的电子式: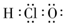 ?????????????????????????????④葡萄糖的实验式:CH2O
?????????????????????????????④葡萄糖的实验式:CH2O
⑤聚乙烯的结构简式: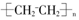 ????????????????????⑥CO2的比例模型:
????????????????????⑥CO2的比例模型: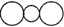
A.①②④
B.②③⑥
C.①④⑤
D.③⑤⑥
参考答案:C
本题解析:②不正确,乙酸的分子式是C2H4O2;③不正确,应该是 ;碳原子半径大于氧原子半径,所以选项⑥不正确,答案选C。
;碳原子半径大于氧原子半径,所以选项⑥不正确,答案选C。
本题难度:一般
3、计算题 (8分)金属X和非金属Y可:直接化合生成化合物XY,甲、乙、丙三人分别做X和Y的化合反应实验,充分反应时,每人所用X和Y的质量各不相同,但总质量均为12g,有关实验数据如下表示:
?
| X用量
| Y用量
| 得XY量
|
甲
| 10g
| 2g
| 8g
|
乙
| 6g
| 6g
| 8g
(1)利用表中数据判定X和Y恰好完全反应时,X和Y的质量比为:________ 。
(2)若丙同学在实验中只得到6gXY,试通过计算说明丙同学X和Y的用量分别是多少?
参考答案:(1)3∶1
(2)若X过量,m(X)=10.5g?
本题解析:(1)根据甲乙的数据对比可知,6gX和2gY恰好反应,因此质量之比是3∶1。
(2)根据题意可知,X和Y一定有过量的。所以如果X过量,则需要Y是2g×6、8=1.5g,因此m(X)=12g-1.5g=10.5g ;如果Y过量,则需要X是6g×6/8=4.5g,所以m(Y)=12g-4.5g=7.5g。
本题难度:一般
4、选择题 将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再缓慢通入HCl气体6.72L(标准状况),若反应过程中溶液的体积保持不变,则( )
A.反应过程中得到6.72L的气体(标准状况)
B.最终得到的溶液中溶质为NaCl和NaOH
C.最终得到15.6g的沉淀
D.最终得到的溶液中NaCl的物质的量浓度为1.5mol/L
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列化学方程式中,不正确的是( )
A.Cu+2HCl=CuCl2+H2↑
B.Fe+CuSO4=FeSO4+Cu
C.Al2O3+2NaOH=2NaAlO2+H2O
D.2Al+Fe2O3 ?高温?
.
?
2Fe+Al2O3
参考答案:A
本题解析:
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772