微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有A、B、C三种化合物,各取40g相混合,完全反应后,得到18.0g?B、49.0g?C、还有D生成,已知D的式量为106。现将22.0g?A和11.0g?B反应,能生成D的物质的量为 [???? ]
A.1.00mol????
B.0.500mol?????
C.0.275mol??
D.0.250mol
参考答案:D
本题解析:
本题难度:一般
2、选择题 将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol/L的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
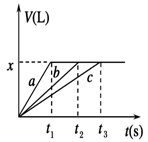
A.x=2.24
B.钠的物质的量为0.2 mol
C.反应时,Na、Mg、Al均过量
D.曲线b为Mg与盐酸反应的图像
参考答案:C
本题解析:
试题分析:钠是活泼的金属,极易与水反应,因此钠与盐酸的反应速率最快,而镁或铝与水不反应,只能与盐酸反应,因此a表示钠,b表示Mg,c表示Al。根据图像可知,反应中生成的氢气体积相同,所以参加反应的盐酸是相同,即金属再与盐酸反应时盐酸不足,金属过量。但过量的金属钠会继续与水反应放出氢气,所以根据方程式2Na+2HCl=2NaCl+H2↑可知钠的物质的量只能是0.1L×2mol/L=0.2mol,则镁和铝的物质的量也是0.2mol。氢气的物质的量是0.2mol÷2=0.1mol,标准状况下的体积是2.
本题难度:一般
3、填空题 (1)3.01×1022个OH- 的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________。
(2)相同状况下,10mL X2气体与30mL Y2气体化合生成20mL C气体,则C的化学式为_________。
(3)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1?,
c(Cl- ) =3.5×10-3 mol·L-1,c(NH4+) =2.3×10-3 mol·L-1, c(SO42-) =1.5×10-3
mol·L-1。则该溶液中氢离子的浓度为_________。
参考答案:(1)0.05 mol,0.85 g,0.45 mol,0.
本题解析:
试题分析:(1)3.01×1022个OH- 的物质的量为:3.01×1022÷6.02×1023mol-1=0.05mol;质量为:0.05mol×17g/mol=0.85g;1个OH?含有9个质子,所以含有质子的物质的量为:0.05mol×9=0.45mol;1个OH?含10个电子,所以含电子的物质的量为::0.05mol×10=0.5mol。
(2)根据阿伏伽德罗定律,气体体积之比等于物质的量之比,所以该反应为:X2+3Y2=2C,再根据质量守恒定律,反应前后原子的种类和数目相等,C的化
本题难度:简单
4、选择题 下列物质中所含指定的微粒数为阿伏加德罗常数的是????(???)
A.常温常压下,2.2g14CD4所含质子数
B.常温常压下,46g二氧化氮和四氧化二氮混合气体中所含氧原子总数
C.标准状况下,11.2LH2O含有氢氧键
D.1.0L 1mol/L氨水中,NH3·H2O的分子数
参考答案:A
本题解析:A正确,14CD4的相对分子质量为22,且为10个质子数的分子,2.2g14CD4的物质的量为1mol,所以所含质子数有阿伏加德罗常数个;B错,46g二氧化氮和四氧化二氮混合气体可看作是46g二氧化氮气体,46g二氧化氮的物质的量为1mol,含有2NA个氧原子;C错,水在标准状况下为非气体;D错,NH3·H2O要电离,所含分子数小于阿伏加德罗常数个;
本题难度:一般
5、填空题 (8分)H2SO4的摩尔质量是?????????????,196g H2SO4的物质的量是?????????,其中含有???????g O和???????molH。
参考答案:98g/L? 2mol?? 128?? 4
本题解析:
试题分析:如果质量的单位用g表示,则摩尔质量在数值上等于物质的相对分子质量或相对原子质量,所以硫酸的摩尔质量是98g/mol。根据n=m/M可知,196g硫酸的物质的量是196g÷98g/mol=2mol。根据硫酸的化学式可知,含有2mol×2=4mol氢原子和2mol×4mol=8mol氧原子,则氧原子的质量是16g/mol×8mol=128g。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式 本题难度:一般
本题难度:一般