微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)Na2S2O8溶液可降解有机污染物4-CP,原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-)。通过测定4-CP降解率可判断Na2S2O8溶液产生(SO4-·)的量。某研究小组探究溶液酸碱性、Fe2+的浓度对产生(SO4-·)的影响。

(1)溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强,????????????????(填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
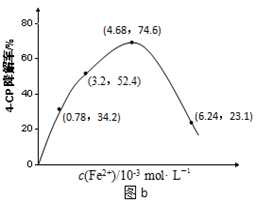
(2)Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。
已知 S2O82?- + Fe2+= SO4-·+ SO42- + Fe3+,此外还可能会发生:SO4-· + Fe2+=SO42- + Fe3+
① 实验开始前,检验FeSO4溶液是否被氧化的试剂是 ????????????(化学式)。如被氧化可以观察到的现象是?????????????????????。
②当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为??????%,4-CP降解的平均反应速率的计算表达式为????????????????????????????????。
③当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是?????????????????????????。
参考答案:(1) 有利于???????????????????????
本题解析:
试题分析:⑴据图a分析,PH越小(酸性越强),4-CP的降解率增大,则Na2S2O8溶液产生SO4-的量增多,即溶液酸性增强,有利于Na2S2O8产生SO4-。
⑵①FeSO4溶液被氧化产生Fe3+,可向溶液中加入KSCN检验,若溶液变红说明FeSO4溶液已被氧化,反之,没有被氧化。
②据图b中的数据分析知,当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为52.4%;则4-CP降解的平均反应速率的计算表达式为= 本题难度:一般
本题难度:一般
2、选择题 100毫升12?摩/升盐酸溶液与过量锌粉反应,在一定温度下,为了减慢反应进行的速度,但又不影响生成氢气的总量,可向反应物中加入适量的
①碳酸钙粉末????????②氯化钠溶液????????③氯化铵(固体)??????④水( )
A.①、②
B.①、③
C.②、③
D.②、④
参考答案:①加入碳酸钙粉末,碳酸钙粉末与盐酸反应,降低溶液中H+离子的
本题解析:
本题难度:简单
3、选择题 温度为500℃时,反应4NH3+5O2 4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
A.v(O2)=0.01mol/(L?s)
B.v(NO)=0.01mol/(L?s)
C.v(H2O)=0.006mol/(L?s)
D.v(NH3)=0.005mol/(L?s)
参考答案:D
本题解析:
试题分析:NO反应速率为0.3mol/2L?0.5min = 0.3mol/(L?min)= 0.005mol/(L?s),反应速率之比等于化学计量数之比。故选择D
考点:化学反应速率计算
本题难度:一般
4、选择题 一密闭容器中发生反应:2SO2(g)+O2(g)=2SO3(g)△H<0,如图表示该反应的速率(v)在某一时间内的变化.则下列时间段中,SO3的百分含量最高的是( )
A.t0→t1
B.t2→t3
C.t3→t4
D.t5→t6
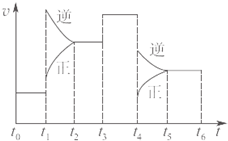
参考答案:分析图象可知,t2→t3是原平衡逆向移动后建立的平衡,SO3
本题解析:
本题难度:简单
5、选择题 在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)?υ(B)、υ(C)(mol?L-1?s-1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示关系:υ(B)=3υ(A);3υ(C)=2υ(B).则此反应可表示为( )
A.2A+3B=2C
B.A+3B=2C
C.3A+B?2C
D.A+3B?2C
参考答案:可逆反应,A与B反应生成C,由于υ(B)=3υ(A);3υ(
本题解析:
本题难度:一般