微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 设水的电离平衡线如图所示。
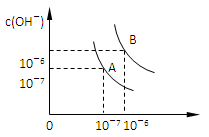
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到______。
(2)pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积 比为_________。
比为_________。
(3)若在某温度下,重水( D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
参考答案:(1) 10-14??????? 10-12(2)2∶9(3
本题解析:略
本题难度:一般
2、实验题 高氯酸铵样品中 NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下:
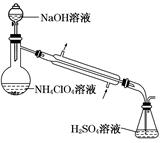
步骤 1:按如图所示组装仪器,检查装置气密性。
步骤 2:准确称取样品a g (约 0.5 g)于蒸馏烧瓶中,加入约 150 mL 水溶解。
步骤 3:准确量取 40.00 mL 约 0.1 mol·L-1 H2SO4溶液于锥形瓶中。
步骤 4:经滴液漏斗向蒸馏烧瓶中加入 20 mL 3 mol·L-1NaOH 溶液。
步骤 5:加热蒸馏至蒸馏烧瓶中剩余约 100 mL 溶液。
步骤 6:用新煮沸过的水冲洗冷凝装置 2~3 次,洗涤液并入锥形瓶中。
步骤 7:向锥形瓶中加入酸碱指示剂,用 c mol·L-1NaOH 标准溶液滴定至终点,消耗 NaOH 标准溶液 V1 mL。
步骤 8:将实验步骤 1~7 重复 2 次。
①步骤 3中,准确量取 40.00 mL? H2SO4溶液的玻璃仪器是???????。
②步骤 1~7 中,确保生成的氨被稀硫酸完全吸收的实验步骤是???????(填步骤序号)。
③为获得样品中 NH4ClO4的含量,还需补充的实验是???????????。
参考答案:①酸式滴定管
②1,5,6
③用NaOH标准溶液
本题解析:①准确量取40.00 mL H2SO4溶液可以选用量程为50 mL的酸式滴定管。③本实验采用高氯酸铵与氢氧化钠溶液反应,生成的氨气与过量的稀硫酸反应,再用已知浓度的氢氧化钠溶液滴定剩余的硫酸,从而计算出产生的氨气的物质的量,进一步换算出样品中高氯酸铵的含量。因步骤3中所给H2SO4的浓度值非精确值,故为了提高实验结果的准确度,还应该用氢氧化钠标准溶液标定硫酸的浓度。
本题难度:一般
3、选择题 (原创题)25℃时,水的电离平衡:H2O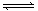 H++OH—?△H>0,下列叙述正确的是(?????)
H++OH—?△H>0,下列叙述正确的是(?????)
A.向水中加入稀氨水,平衡逆向移动,c(OH—)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体NaOH,平衡逆向移动,c(OH—)降低
D.将水加热,Kw增大,c(H+)不变
参考答案:B
本题解析:A错,向水中加入稀氨水,平衡逆向移动,但c(OH—)增大;B正确,Kw只受温度影响;C错,向水中加入少量固体NaOH,平衡逆向移动,c(OH—)增大;D错,将水加热,Kw增大,c(H+)增大;
本题难度:一般
4、选择题 水的电离平衡曲线如右图所示,下列说法不正确的是??(??)
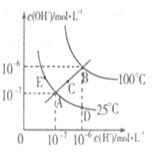
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4C1固体的方法
D.若处在B点时,将pH =2的硫酸溶液与pH = 10的KOH溶液等体积混合,所得溶液呈中性
参考答案:C
本题解析:Kw与温度有关,温度越高值越大,EAD在一条等温线上,所以相等,B>C>A=D=E,因为温度升高。A正确。若从A点到D点,C(H+)变大,C(OH-)变小,可采用在水中加入少量酸的方法。B正确。若从A点到C点,Kw改变温度改变。C错误。若处在B点时,Kw=10-12(mol/L)2?pH =2的硫酸溶液与pH = 10的KOH溶液等体积混合,所得溶液呈中性.
本题难度:一般
5、填空题 某学生在实验室测定溶液的pH时,先将pH试纸用蒸馏水润湿后再进行测定,其测定结果是否一定有误差?_____________,理由是_______________________________________。若用此方法分别测定c(H+)相等的H2SO4和H3PO4的pH,误差较大的是_____________,理由是_______________________________________。
参考答案:不一定?若待测液呈中性,则润湿时稀释后仍为中性? H2SO4
本题解析:待测液稀释后pH不一定改变,例如NaCl等中性溶液。弱酸稀释时可电离出H+,故pH变化小。
本题难度:简单