微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g) 2C(g),2min后反应达到平衡,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
2C(g),2min后反应达到平衡,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
A.平衡时,物质的量比A∶B∶C=2∶11∶4
B.x值等于4
C.A的转化率20%
D.B的平均反应速率为0.4 mol·L-1·min-1
参考答案:AD
本题解析:略
本题难度:简单
2、填空题 开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)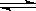 CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=???????;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA????tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:????????????????????????????????????。
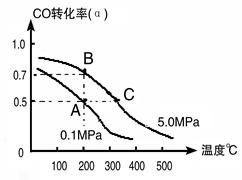
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是???????????,曲线Ⅱ对应的实验条件改变是???????。
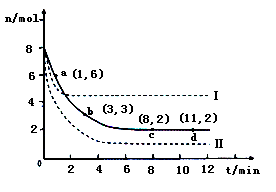
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
①下列说法中正确的是?????。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是?????(填晶体类型)。
参考答案:(1)①K="0.25" (2分)??②大于(2分) ③原料
本题解析:
试题分析:(1)①?????2CO(g)+4H2(g)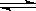 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
起始浓度(mol/L) 1????? 2???????????? 0?????????? 0
转化浓度(mol/L)0.5??? 1.0??????????? 0.25?????? 0.25
平衡浓度(mol/L)0.5??? 1.0??????????? 0.25????? 0.25
根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该温度下反应的平衡常数K=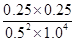 =0.25。
=0.25。
②根据图像可知,C点温度和压强均大于A点温度和压强,所以C点反应速率快,达到平衡的时间少。
③由于氮气中CO2的含量逐渐增大,所以该方法的优点是原料易得、可以减轻温室效应。
(2)①根据图像可知平衡时氢气的物质的量是2mol,消耗氢气的物质的量是8mol-2mol=6mol,所以根据方程式可知平衡时生成甲醇的物质的量是2mol,因此图像可表示为见答案。
②曲线I与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量增加,说明平衡向逆反应方向移动。由于正方应是体积减小的可逆反应,所以改变的条件只能是升高温度,即正方应是放热反应;曲线Ⅱ与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量减少,这说明平衡向正反应方向移动。由于正方应是体积减小的放热的可逆反应,所以改变的条件只能是增大压强。
(3)①A.Hg2+水解溶液显酸性,所以为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释,A正确;B.当c(C1ˉ) =10ˉ1 mol·Lˉ1即pCl=1时,汞元素主要是以HgCl42ˉ形式存在,B不正确;C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2 HgCl+ + HgCl3ˉ,C不正确;D.根据图像可知当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,D正确,答案选AD。
HgCl+ + HgCl3ˉ,C不正确;D.根据图像可知当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,D正确,答案选AD。
②HgCl2又称“升汞”,熔点549K,加热能升华,这说明晶体是分子晶体。
本题难度:困难
3、选择题 可逆反应达到平衡的重要特征是(??? )
A.反应停止了
B.正、逆反应的速率相等
C.正、逆反应都还在进行
D.正、逆反应的速率均为零
参考答案:B
本题解析:
试题分析:逆反应达到平衡的重要特征是:正、逆反应速率相等,即:v(正) = v(逆)。B选项正确。 v(正) = v(逆) ≠0,故A、D两选项错误。可逆反应一旦发生,不论平衡与不平衡,正、逆反应都在进行。故 C选项错误。 所以选B。
点评:本题考了化学平衡状态建立及化学平衡状态的特征。了解“逆,等,动,定,变”是化学平衡状态的特征。即可顺利完成此类题目。
本题难度:简单
4、选择题 下列事实不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.在硫化氢水溶液中加入碱有利于S2-
参考答案:B
本题解析:勒夏特列原理是指:如果改变影响平衡的条件之一(如浓度、温度、压强),平衡将会向着能够减弱这种改变的方向上移动;
A可以,啤酒中存在平衡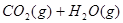 ?
?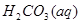 开启瓶盖后,压强减小,平衡将向逆反应方向移动;B错,反应存在平衡
开启瓶盖后,压强减小,平衡将向逆反应方向移动;B错,反应存在平衡 ?
? 加压,碘蒸气浓度增大,颜色加深;但平衡不移动;C可以,氯水中存在平衡
加压,碘蒸气浓度增大,颜色加深;但平衡不移动;C可以,氯水中存在平衡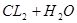 ?
?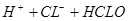 ,加碳酸钙后,会与溶液中的氢离子反应,使平衡向正反应方向移动,溶液中的HCLO溶液增大,漂白性增强;D正确,硫化氢溶液中有平衡:
,加碳酸钙后,会与溶液中的氢离子反应,使平衡向正反应方向移动,溶液中的HCLO溶液增大,漂白性增强;D正确,硫化氢溶液中有平衡: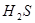 ?
?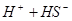 ,加碱,中和氢离子,使硫化氢的向电离方向移动生成更多的硫离子;
,加碱,中和氢离子,使硫化氢的向电离方向移动生成更多的硫离子;
本题难度:一般
5、选择题 某温度下,在一固定体积的密闭容器中,进行如下化学反应:H2(g)+I2(g)  ?2HI(g),下列情况能说明该反应一定达到平衡状态的是
?2HI(g),下列情况能说明该反应一定达到平衡状态的是
A.混合气体的颜色不再改变
B.混合气体的压强不再改变
C.单位时间内拆开1mol H-H键,同时生成2mol H-I键
D.混合气体的密度不再改变
参考答案:A
本题解析:A可判断,混合气体的颜色不变也就是碘单质浓度不变,可用于判断平衡是否达到。
B不可判断,该反应前后气体系数不变,没有体积差,无论是否平衡,压强都不会变化。
C不可判断,氢气的分解和碘化氢的生成都是同一个方向,不能说明是否达到平衡。
D不可判断,该反应没有体积差,密度无论是否达到平衡都不会发生改变。所以正确答案是A。
本题难度:一般