微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 把6 molA气体和5 molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经5min达到平衡,此时生成2molC,测得D的平均反应速率为0.15 mol·(L·min)-1,求;(1)平衡时A的物质的量浓度
2C(g)+xD(g),经5min达到平衡,此时生成2molC,测得D的平均反应速率为0.15 mol·(L·min)-1,求;(1)平衡时A的物质的量浓度
(2)B的转化率
(3)x的值
(4)平衡混合物中B的体积分数?
参考答案:每小题2分,共8分。
(1)0.75mol/L?? (
本题解析:略
本题难度:一般
2、计算题 在一定温度下,把2 mol SO2和1mol O2通入一个一定容积的密闭容器里,发生如下反应:
2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
当此反应进行到一定程度时,反应混合物就处于平衡状态,现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2、SO3的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证平衡时反应混合物中3种气体的百分含量,仍跟上述平衡时完全相同,请填写下列空白:
(1)若a=0,b=0,则c=___________;
(2)若a=0.5,则b=___________和c=___________;
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c):___________。
参考答案:(1)若a=0,b=0,则c=2;
(2)若a=0.5
本题解析:
提示:在一定温度下,2SO2+O2 2SO3(g)这个可逆反应,起始态是2 mol SO2和1molO2,还是2molSO3,达到化学平衡时,混合物中各组分的百分含量相同。
2SO3(g)这个可逆反应,起始态是2 mol SO2和1molO2,还是2molSO3,达到化学平衡时,混合物中各组分的百分含量相同。
本题难度:一般
3、填空题 (14分)T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。?
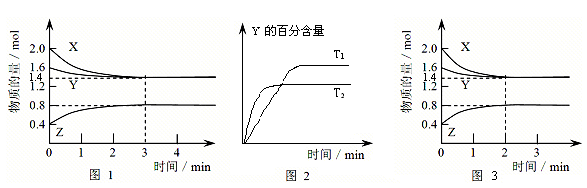
(1)容器中发生的反应可表示为______?________?________?__
(2)该反应的△H?????0(填“>”、“<”或“=”)
判断理由是:______?________?________?________?____?________?__。
(3)反应进行的前3 min内,用X表示的反应速率 v(X)=____________
(4)保持其他条件不变,升高温度,该反应的化学平衡常数K将____________(填“变大”、“减小”或“不变”)
(5)①若改变反应条件,使反应进程如图3所示,则改变的条件是____________
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压???? b.加入催化剂??? c.增加X的浓度??? d.增加气体Y的浓度???
参考答案:(1)3X(g)+??? Y (g)  本题解析:(1)根据特异性1可知,XY的物质的量分别减 少了2.0mol-1.4mol=0.6mol、1.6mol-1.4mol=0.2mol。Z的物质的量增加了0.8mol-0.4mol=0.4mol。所以根据变化量之比是相应的化学计量数之比可知,方程式为3X(g)+Y (g)
本题解析:(1)根据特异性1可知,XY的物质的量分别减 少了2.0mol-1.4mol=0.6mol、1.6mol-1.4mol=0.2mol。Z的物质的量增加了0.8mol-0.4mol=0.4mol。所以根据变化量之比是相应的化学计量数之比可知,方程式为3X(g)+Y (g)  2Z(g)。
2Z(g)。
(2)根据图像2可知,T1小于T2,温度高,Y的含量低,说明升高温度平衡向正反应方向移动,所以正反应是吸热反应,即△H大于0.
(3)反应进行的前3 min内,用X表示的反应速率 v(X)= =0.1 mol/(L? min)。
=0.1 mol/(L? min)。
(4)保持其他条件不变,升高温度,平衡平衡向正反应方向移动,平衡常数增大。
(5)①根据图像3可知,平衡状态没有改变,说明改变的条件是加入了催化剂。
②因为正反应是体积减小的、吸热的可逆反应,所以升高温度或增大压强,平衡都向正反应方向移动,转化率增大,a正确。催化剂不能改变平衡状态,b不正确。增加X的浓度,平衡向正反应方向移动,Y的转化量增大,c正确。增加Y的浓度,平衡向正反应方向移动,但Y的转化率降低d不正确,答案选ac。
本题难度:一般
4、选择题 在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(气)+B(气) C(气)+D(气)
C(气)+D(气)
5 min后达到平衡。已知各物质的平衡浓度的关系为:
[A]a[B]=[C][D]</PGN0039A.TXT/PGN>
若在温度不变的情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为??
A.60%
B.40%
C.24%
D.4%
参考答案:B
本题解析:
容器体积扩大,但A转化率不变,可见反应前后总体积不变,因此a=1,方程式:
A(g)+ B(g) 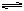 ?C(g)+? D(g)
?C(g)+? D(g)
起始量????????????? 2???? 3??????? 0???? 0
变化量????????????? x???? x??????? x???? x
平衡量????????????? 2-x?? 3-x????? x???? x
平衡时????????????? [A][B]=[C][D]
∴(2-x)(3-x)=x2
∴x=1.2
本题难度:一般
5、选择题 在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ?Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
?Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将增大
参考答案:BD
本题解析:根据题目得出,温度越高,平衡常数越小,平衡应该向左移动,正反应应该是放热反应,A错误;80 ℃时,Ni(CO)4、CO浓度均为0.5 mol·L-1,Q=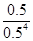 =8>K,故平衡应该逆向移动,因此v(正)<v(逆),B正确;恒温恒压下充入少量的Ar,体积变大,平衡逆向移动,C错误;向容器中再充入少量Ni(CO)4(g),平衡逆向移动,达新平衡时,Ni(CO)4(g)的百分含量将增大,D正确。
=8>K,故平衡应该逆向移动,因此v(正)<v(逆),B正确;恒温恒压下充入少量的Ar,体积变大,平衡逆向移动,C错误;向容器中再充入少量Ni(CO)4(g),平衡逆向移动,达新平衡时,Ni(CO)4(g)的百分含量将增大,D正确。
本题难度:一般