微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭容器中进行的如下反应:2SO2+O2
催化剂
2SO3,下列叙述错误的是( )
A.达到平衡时SO2与SO3的浓度相等
B.使用催化剂是为了加快反应速率,提高生产效率
C.在上述条件下,SO2不可能100%地转化为SO3
D.为了提高SO2的转化率,应适当提高O2的浓度
参考答案:A、反应达到平衡状态时,SO2与SO3的浓度不再发生变化,但
本题解析:
本题难度:简单
2、选择题 进行如下实验,在A锥形瓶中放入10 g绿豆大小的碳酸钙,在B锥形瓶中放入5 g粉末状的碳酸钙,分别加入50 mL 1 mol·L-1盐酸,下图中能正确表示实验结果的是(注:x—时间,y—锥形瓶中碳酸钙减少的质量)( )
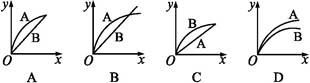
参考答案:C
本题解析:
试题分析:有固体参加的反应速率与固体表面积有关。B锥形瓶中放入粉末状的碳酸钙,所以B中产生的CO2速率比较大;50 mL 1 mol·L-1盐酸最多只能消耗碳酸钙2.5 g,最终产生的CO2应该相等,故C选项的图像符合。
考点:影响化学反应速率的因素
本题难度:一般
3、填空题 将除去氧化膜的镁条插入到稀盐酸溶液中,发现生成氢气的速度变化情况如图所示:
其中t1-t2?速度变化的主要原因是
______
t2-t3?速度变化的主要原因是______.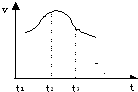
参考答案:由图可知,t1-t2?速度增大,是因该反应为放热反应,随着反
本题解析:
本题难度:一般
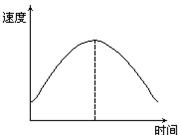
4、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速度可由图表示,在下列因素中,①盐酸的浓度②镁条的表面积③溶液的温度④Cl-的浓度,影响反应速度的因素是
A.①④
B.③④
C.①②③
D.②③
参考答案:C
本题解析:镁条和盐酸反应产生H2的反应方程式为:Mg+2H+=Mg2++H2↑,是镁与酸中的H+间的置换反应,与Cl-无关。故④不是影响该反应速度的因素。
在镁条的表面有一层氧化膜。当将Mg条投入盐酸中时,随着氧化膜的不断溶解,Mg与盐酸接触面积不断增大,则产生H2的速度会加快。溶液的温度对该反应也有影响,温度越高,产生H2的速度越快。随着反应的进行,H+浓度不断减少,则反应速度会逐渐减慢。故选C。
本题难度:一般
5、简答题 一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的:①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CH3COONa固体;⑥NH4Cl固体;⑦CuSO4固体??⑧CaCO3固体( )
A.①②⑤⑦
B.②③⑥
C.②③④⑤
D.②④⑤
参考答案:①NaOH固体能与盐酸反应,减小生成氢气的总量,故①错误;<
本题解析:
本题难度:一般