微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实中,不能用勒夏特列原理解释的是
A.溴水中有下列平衡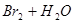

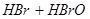 ,当加入
,当加入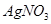 溶液后,溶液颜色变浅
溶液后,溶液颜色变浅
B.对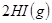

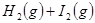 平衡体系,增大平衡体系的压强可使颜色变深
平衡体系,增大平衡体系的压强可使颜色变深
C.反应

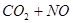 (正反应放热),升高温度可使平衡向逆反应方向移动
(正反应放热),升高温度可使平衡向逆反应方向移动
D.打开啤酒瓶盖后产生大量的气泡
2、选择题 H2C2O4可使酸性KMnO4溶液褪色(Mn2+可作该反应的催化剂),依据褪色时间的长短可比较反应进行的快慢.下列实验中溶液褪色最快的一组是( )
| 组号 | 反应温度/℃ | 参加反应物质
|
| KMnO4 | H2C2O4
MnSO4
V/mL
c/mol?L-1
V/mL
c/mol?L-1
m/g
A
20
4
0.1
1
0.1
0
B
20
4
0.1
2
0.1
0
C
40
4
0.1
2
0.1
0
D
40
4
0.1
2
0.1
0.1
A.A
B.B
C.C
D.D
3、填空题 (9分)某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
实验编号
|  T/K T/K
| KMnO4浓度
/mol·L-1
| H2C2O4浓度
/mol·L-1
| 实验目的
| ①
| 298
| 0.01 mol·L-1
| 0.1 mol·L-1
| 为以下实验做对照
| ②
| ?
| ?
| ?
| ?
| ③
| ?
| ?
| ?
| 探究浓度对反应速率的影响
(2)实验记录:实验中需要记录的数据是???????????????????????????????????。
4、选择题 一定量的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可采取的措施是
A.将铁粉改为铁片
B.向稀H2SO4中加入少量的CuSO4溶液
C.向稀H2SO4中加入少量的CH3COONa固体
D.向稀H2SO4中加入少量的NaOH固体
5、选择题 决定化学反应速率的主要因素是
[???? ]
A.反应温度
B.使用催化剂
C.外界压强
D.反应物的性质
|
|