微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
元素
| 相关信息
|
W
| W的基态原子L层电子数是K层电子数的3倍
|
X
| X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝
|
Y
| 单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4
|
Z
| Z的基态原子外围电子排布式为(n-1)d10ns1
(1)Y位于元素周期表第________周期第________族;X的基态原子核外电子排布式是 。
(2)W的简单离子半径 X的简单离子半径(填“>”、“<”或“=”);Y的第一电离能比Z的 (填“大”或“小”);W、X的最简单气态氢化物中,沸点较高的是 (填化学式)。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,该反应的化学方程式为 。
(4)W元素形成的多种化合物分子中,含有极性共价键和非极性共价键的分子名称为
(任写一种)。
(5)在25℃、101 kPa下,已知Z固体单质在Y2气体中完全燃烧后恢复至原状态,平均每转移1mol 电子放热110.05kJ,该反应的热化学方程式是 。
参考答案:(1)三 ⅦA(2分) 1s
本题解析:
试题分析:W的基态原子L层电子数是K层电子数的3倍,则W为O元素;X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝,则X为N元素;Y的单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4,则Y为Cl元素;Z的基态原子外围电子排布式为(n-1)d10ns1,因为这四种元素位于元素周期表的前四周期,所以Z为CuO。
(1)Y为Cl元素,位于元素周期表第三周期、ⅦA族;X为N元素,其基态原子核外电子排布式为:1s22s22p3
(2)O2?与N3?电子排布相同,原子序数越大,离子半径越小,所以O2?半径<N3?半径;Y为Cl元素,为活泼非金属元素,Z为Cu元素,为金属元素,所以Cl的第一电离能大于Cu的第一电离能;W、X的最简单气态氢化物分别为H2O和NH3,常温下,H2O是液体而NH3是气体,所以H2O的沸点高。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,H2把CuO还原为Cu2O,化学方程式为:2CuO + H2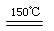 Cu2O + H2O Cu2O + H2O
(4)氧元素形成的化合物中,含有极性共价键和非极性共价键的分子,最常见的为过氧化氢。
(5)首先写出化学方程式并注明物质的状态,每转移1mol 电子放热110.05kJ,则1molCu完全反应放热-220.10kJ,进而写出热化学方程式为:Cu(s) +Cl2(g)=CuCl2(s) △H=-220.10kJ/mol
考点:本题考查元素的推断、元素周期律和元素周期表、化学方程式和热化学方程式的书写。
本题难度:困难
2、填空题 由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2 (g) + O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
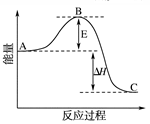
①V2O5的使用会使图中B点 (填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为 mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。
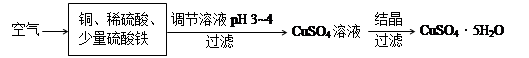
①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量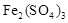 起催化作用,使反应按以下两步完成: 起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步: 。(用离子方程式表示)
②调节溶液pH为3~4的目的是 ,调节时加入的试剂可以为 。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式: 。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式: 。
参考答案:(1)①降低(1分) ②a+b(1分) ![]()
本题解析:
试题分析:(1)①催化剂能降低反应的活化能,所以V2O5的使用会使图中B点降低。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则根据S原子守恒可知,SO2起始物质的量浓度为(a+b)mol/L;反应速率通常用单位时间内浓度的变化量来表示,所以生成SO3的化学反应速率为 mol/(L·min)。 mol/(L·min)。
(2)①由于催化剂在反应前后不变,因此根据总反应式和第一步反应式可知,总反应式减去第一步反应式即得到第二步反应式,即第二步反应式为4Fe2++O2+4H+=4Fe3++2H2O
②由于溶液中含有铁离子,会干扰硫酸铜的制备,因此需要将铁离子除去。所以调节溶液pH的目的就是将Fe3+转化为Fe(OH)3沉淀除去。又因为在除去铁离子的同时,不能在引入新的杂质,因此不能 选择氢氧化钠和氨水,应该选择氧化铜或碱式碳酸铜,即答案选bc。
(3)①已知反应①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1、②2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则根据盖斯定律可知①+②即得到反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g),所以该反应的反应热ΔH=140 kJ·mol-1-221 kJ·mol-1=-81 kJ·mol-1。
②根据TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解可知,TiCl4(l)制取纳米TiO2的化学方程式为TiCl4+2H2O TiO2+4HCl。 TiO2+4HCl。
考点:考查催化剂对活化能的影响、反应速率计算;物质的分离与提纯;反应热的计算以及物质制备等
本题难度:困难
3、选择题 关于化学反应与能量的说法正确的是( )
A.根据如图提供的信息,该反应是放热反应
B.化学变化中的能量变化主要由化学键变化引起的
C.化学反应中只伴随热量的变化
D.CaCO3(s)=CaO(s)+CO2(g)△H=+178.5KJ?mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5KJ的热量
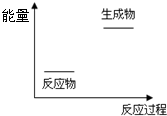
参考答案:B
本题解析:
本题难度:一般
4、选择题 在同温同压下,下列各组热化学方程式中,Q1>Q2的是
A.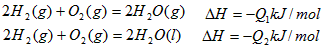
B.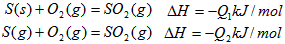
C.
D.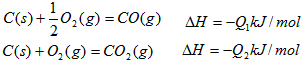
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列叙述中,正确的是( ) A.甲烷的标准燃烧热为890.3?kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3?kJ?mol-1
B.500℃、30?MPa下,将0.5?mol?N2和1.5?mol?H2置于密闭的容器中充分反应生成NH3(g),放热19.3?kJ,其热化学方程式为:
N2(g)+3H2(g) 2NH3(g)△H=-38.6?kJ?mol-1 2NH3(g)△H=-38.6?kJ?mol-1
C.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
D.常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0
参考答案:D
本题解析:
本题难度:简单
|