微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4和碳粉涂覆在铝箔上)进行资源回收研究,设计实验流程如下
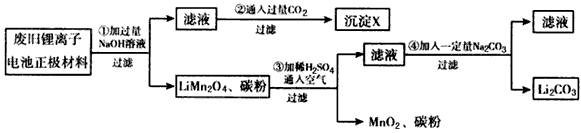
(1)第①步反应可能产生气体的化学式是________;第②步反应得到的沉淀X的化学式为_______。
(2)第③步反应有锂离子(Li+)生成,其反应的离子方程式是___________________。
(3)四步实验都包含过滤,实验室中过滤实验要使用的玻璃仪器包括_______。
(4)若废旧锂离子电池正极材料含LiMnO4的质量为18.1 g,第③步反应中加入 20.0 mL 3.0mol/L的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有______g Na2CO3参加了反应。
参考答案:(1)H2;Al(OH)3
(2)4LiMn2O4+
本题解析:
本题难度:一般
2、实验题 某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.请你帮助该学生整理并完成实验报告
(1)实验目的:对同主族元素性质递变规律进行探究
实验用品:仪器:试管、胶头滴管等药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳
实验内容(在下列空格内填写相关内容)
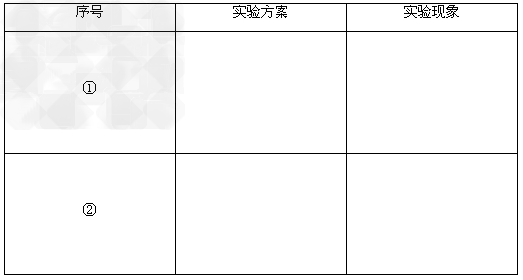
(2)实验结论:_________________________
(3)问题和讨论:
①请用物质结构理论简单说明得出上述结论的原因______________________
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱.试列举一个事实说明F的非金属性比Cl强:____________________
参考答案:“略”
本题解析:
本题难度:一般
3、实验题 为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)_____________________________。
供选用试剂:a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案I.取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。
方案II.向VmL?c?mol/L酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色。
方案III,取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg。
①其中不合理的方案是______________,理由是_____________________。
②选择合理方案的数据计算气体Y中SO2的体积分数________(用含未知数的代数式表示。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持装置已省略)。
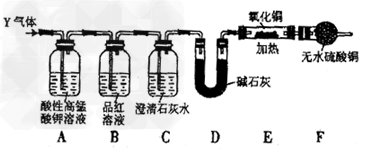
(3)装置A中试剂的作用是____________________。
(4)简述确认气体Y中含有CO2的实验现象:_____________________。
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?_______(填“可靠”或“不可靠”),简述理由:____________________。
参考答案:(1)取少量X溶液装于试管,向试管中滴加酸性高猛酸钾溶液,若
本题解析:
本题难度:一般
4、填空题 “烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
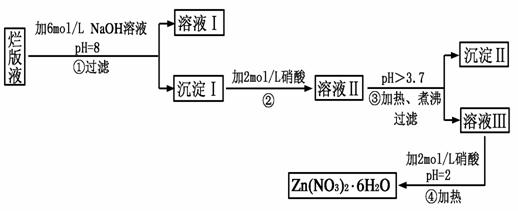 ???????????????
???????????????
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式_____________________________。
(2)在操作①中保持pH=8的目的是____________________________。
(3)沉淀Ⅰ的主要成分是_______________________________________。
(4)操作③中加热、煮沸的目的是________________________________;
此步骤操作的理论依据是____________________________________。
(5)操作④保持pH=2的目的是__________________________________;
此步骤操作中所用的主要仪器是________________________________。
参考答案:(1)Zn(NO3)2
4Zn+10HNO3===4Z
本题解析:略
本题难度:简单
5、选择题 下列有关化学反应现象或化学原理的解释错误的是(???)
A.SO2使品红褪色的机理和使酸性KMnO4褪色的机理一样
B.蛋白质溶液和蔗糖溶液可以用丁达尔现象来区别,因为分散质颗粒大小不同
C.将BaSO4投入饱和Na2CO3溶液,能生成BaCO3,据此可确定Ksp(BaCO3)< Ksp(BaSO4
D.(NH4)2CO3(s)=NH4HCO3(s) +NH3(g)△H>0在室温下能自发,因为体系熵值增大
参考答案:AC
本题解析:A 错误,SO2使品红褪色体现了漂白性,使酸性KMnO4褪色体现了还原性
B 正确,蛋白质溶液是胶体,能产生丁达尔现象,蔗糖溶液不是胶体,不产生丁达尔现象。
C 错误,更难溶的物质也能转变为难溶的物质,Ksp(BaCO3)>sp(BaSO4)
D 正确,此反应中,△H>0,△S<0,导致△G<0,反应能自发进行。
本题难度:一般