结论
A
氢氧化铝可以溶解在氢氧化钠溶液中
氢氧化铝属于碱
B
CO2的水溶液可导电
CO2是电解质
C
SO2通入酸性高锰酸钾溶液,溶液褪色
SO2有漂白性
D
铁分别和氯气、硫反应得到氯化铁和硫化亚铁
氯气的氧化性大于硫
A.A
B.B
C.C
D.D
参考答案:A、氢氧化铝可以溶解在氢氧化钠溶液中,说明氢氧化铝可以和强碱
本题解析:
本题难度:一般
2、实验题 I、亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含
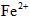 34%~36%,是糖衣片,……,与 34%~36%,是糖衣片,……,与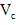 (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验: (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:
(1)第一步:查阅资料得知,双氧水可以氧化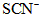 生成 生成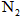 、 、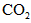 和SO42-,也可以将 和SO42-,也可以将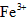 氧化成 氧化成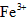 。 。
(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有Fe2+离子存在;
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量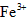 离子存在。该离子存在的原因可能是(填序号):___________________ 离子存在。该离子存在的原因可能是(填序号):___________________
①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成。
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中。
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的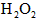 溶液,溶液的红色先变深,之后红色逐渐褪去。 溶液,溶液的红色先变深,之后红色逐渐褪去。
①红色变深的原因是(用离子方程式表示):__________________________;
②请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因:____________________。
(6)第六步:向B试管的溶液中加入一片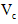 片,片刻后溶液红色也褪去,说明 片,片刻后溶液红色也褪去,说明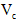 有___________性。 有___________性。
II、以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S,CuFeS2+4Fe3+=Cu2++5Fe2++2S, 2Fe3+ + H2S = 2H+ + S↓ + 2Fe2+。下图为该工艺的示意图。
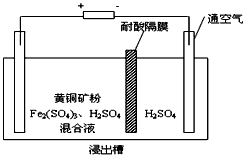
(1)电解过程实现了Fe3+的循环,则阳极方程式为___________________ 。
(2)电解过程中阴极有金属析出,向阴极通空气的原因是________________________。
(3)与燃烧法炼铜相比,电解法的优点为________________________。
参考答案:I、
(3)②③;
(5)①![]()
本题解析:
本题难度:困难
3、实验题 某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)

①该研究小组在设计方案时。考虑了浓度、__________________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响___________________________。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下

①写出H2O2发生的化学反应方程式___________________________。
②实验结果说明催化剂作用的大小与_______________有关。
参考答案:(1)①温度、催化剂;② 升高温度化学反应速率增大(或加催化
本题解析:
本题难度:一般
4、计算题 某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
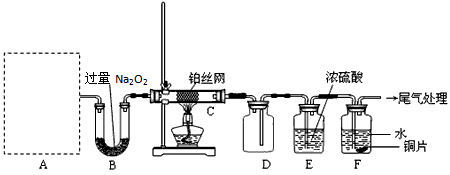
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片 刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________(填代表备选试剂的字母);此时A中主要的玻璃仪器有_________(填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:
__________________。
(3)对于C中发生的可逆反应,下列说法正确的_________。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
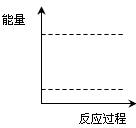
(4)请在下图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是_________mol,甲在标准状况下体积为_________L(忽略气体溶解)。
参考答案:(1)a;试管、酒精灯(导管)
(2)2Na2O2 +
本题解析:
本题难度:一般
5、选择题 下列实验方法使用不合理的是
A.用结晶法从水溶液中获得氯化铁晶体
B.用纸上层析法检验氯化铁溶液中是否混有少量氯化铜
C.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量必需相等
D.用AgNO3溶液、稀硝酸鉴别亚硝酸钠和食盐
参考答案:C
本题解析:
答案:C
A.正确,先向溶液中加适量盐酸,蒸发浓缩、冷却结晶,从水溶液中获得氯化铁晶体;
B.正确,溶质粒子在同一介质中运动的速率不同,用纸上层析法检验氯化铁溶液中是否混有少量氯化铜;
C.不合理,为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量必需有一种过量。
D.正确,用AgNO3溶液、稀硝酸鉴别亚硝酸钠和食盐,食盐形成AgCl沉淀。
本题难度:一般
|