微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子,在pH=0的溶液中可以大量共存的是
A.Al3+、Fe3+、Br-、SO32-
B.K+、Na+、SO42-、NO3-
C.Na+、Cu2+、I-、NO3-
D.NH4+、K+、HCO3-、Cl-
参考答案:B
本题解析:分析:pH=0的溶液呈酸性,如离子之间不发生复分解、氧化还原反应或互促水解反应,则可大量共存,反之不能.
解答:A.酸性条件下Fe3+与SO32-发生氧化还原反应而不能大量共存,且SO32-与氢离子发生反应生成气体,故A错误;
B.离子之间不发生任何反应,可大量共存,故B正确;
C.酸性条件下I-、NO3-发生氧化还原反应而不能大量共存,故C错误;
D.酸性条件下HCO3-不能大量共存,故D错误.
故选B.
点评:本题考查离子共存问题,侧重于元素化合物知识的综合应用,为高考常见题型,注意把握相关离子的性质,注意题目酸性的特点,题目难度不大.
本题难度:一般
2、选择题 3 H2(g) + N2(g)  2NH3(g) 反应过程中的能量变化如下图所示。有关说法错误的是( )
2NH3(g) 反应过程中的能量变化如下图所示。有关说法错误的是( )
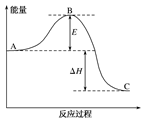
A.图中C表示生成物NH3(g)的总能量
B.断裂3mol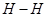 和1mol
和1mol 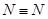 所吸收的总能量大于形成6mol
所吸收的总能量大于形成6mol  所释放的总能量
所释放的总能量
C.逆反应的活化能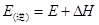
D.3 H2(g) + N2(g)  2NH3(g) △H< 0
2NH3(g) △H< 0
参考答案:B
本题解析:
试题分析:A中根据图像可知图中C表示生成物NH3(g)的总能量,正确;B中该反应为放热反应,所以断裂3mol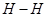 和1mol
和1mol 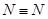 所吸收的总能量小于形成6mol
所吸收的总能量小于形成6mol  所释放的总能量,错误;C中活化能是指断裂化学键所需吸收的能量,所以逆反应的活化能
所释放的总能量,错误;C中活化能是指断裂化学键所需吸收的能量,所以逆反应的活化能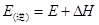 ,正确;D中该反应为放热反应,所以3 H2(g) + N2(g)
,正确;D中该反应为放热反应,所以3 H2(g) + N2(g) 2NH3(g) △H< 0,正确,选B。
2NH3(g) △H< 0,正确,选B。
考点:考查反应热、活化能,化学反应图像等知识。
本题难度:一般
3、实验题 (10分)某化学兴趣小组将两份等质量的硫粉分别在空气、氧气中燃烧,放出的热量是一样多还是不一样多?经过讨论、综合,根据观点分成了两组。
A组:在该过程中参加反应的硫与氧气量相等,反应物和生成物具有的能量都相等,故放出的热量相等。
B组:硫粉在氧气中燃烧比在空气中更剧烈,故在氧气中燃烧放出的热量多。
在老师的帮助下,他们决定用实验来探究其真相,在常温(25℃)下,实验过程如下(不考虑环境的影响):

①称取质量相等的两份硫粉;
②取一份硫粉放在燃烧匙中,伸入弹式量热计(剖面示意图如上)的密封器中;
③在密封器中充满空气的条件下,用电火花引燃,测出反应后内层中水的最高温度为t1;
④取另一份硫粉放在燃烧匙中,在密封器中充满氧气的条件下,用电火花引燃,测出反应后内层中水的最高温度为t2;
回答下列问题:
(1)若A组观点正确,则t1________t2(填“<”、“>”或“=”);
(2)根据实验所测数据显示:t1>t2,这说明结论与________(填“与A组观点”、“B组观点”或“都不”)符合;若填都不符合,那么哪种情况放出热量多?________________;
(3)请对t1>t2这一现象做出合理的解释:_________________________________________________;
(4)通过这个实验同时说明,当条件相同、反应物与生成物的量相同时,反应放出或吸收的热量多少与反应的剧烈程度________(填“有关”或“无关”)。
参考答案:(1)= (2) 都不 在空气中燃烧放出的热量多 (3) 硫
本题解析:
试题分析:由题意可知A组观点为放出的热量相等,则t1=t2;B组观点认为纯氧中放出的热量多,则t1<t2,故实验所测数据显示:t1>t2,这说明结论与A、B两组观点均不同,说明在空气中燃烧放出的热量多,主要原因为硫粉在氧气中燃烧,现象是明亮的蓝紫色火焰,而空气中现象为淡蓝色火焰,故在在氧气中燃烧,以光的形式释放出的能量比在空气中的要多,故硫粉在氧气中燃烧,以热量形式释放出的能量要比在空气中燃烧以热量形式释放出的能量少;通过这个实验同时说明,当条件相同、反应物与生成物的量相同时,反应放出或吸收的热量多少与反应的剧烈程度无关。
考点:化学探究实验。
本题难度:困难
4、选择题 在下列水溶液中进行的各反应中,在反应过程中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键生成的是( )
A.2NaBr+Cl2=2NaCl+Br2
B.2AgOH=Ag2O+H2O
C.2Na+2H2O=2NaOH+H2↑
D.2Na2O2+2H2O=4NaOH+O2↑
参考答案:A.反应物中有非极性键、离子键的断裂,生成物也只有非极性键、
本题解析:
本题难度:一般
5、填空题 (9分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式______________________________________.
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式___________________.
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l ) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______________________.
参考答案:(9分) (1)H2SO4(aq)+
本题解析:略
本题难度:一般