微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH3
NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l) ΔH4
③H2(g)+1/2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.①
B.②④
C.③④
D.①②③
参考答案:C
本题解析:碳完全燃烧放出的热量多,但放热越多,△H越小,所以①中ΔH前者小于后者;②中都是中和热,△H相等;消耗的氢气越多,放出的热量越多,同样放热越多,△H越小,所以③中ΔH前者大于后者;④中前者是吸热反应,后者是放热反应,ΔH前者大于后者,答案选C。
本题难度:一般
2、选择题 已知葡萄糖的燃烧热是 -2804 kJ/mol,当它氧化生成1 g 液态水时放出的热量是
A.26.0 kJ
B.51.9 kJ
C.155.8 kJ
D.467.3 kJ
参考答案:A
本题解析:
试题分析:葡萄糖的燃烧热是 -2804 kJ/mol即1mol葡萄糖完全燃烧生成6mol二氧化碳和6mol液态水时放出2804 kJ的热量,当生成1g液态水时放出热量为1g/18g/mol÷6mol×2804kJ=26.0kJ,答案选A。
考点:燃烧热
本题难度:一般
3、选择题 水是生命之源,也是化学反应中的主角。请回答下列问题:
Ⅰ、氢气燃烧生成液态水热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol。
(1)生成物能量总和(填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)。
(3)氢气热值为 。
Ⅱ、氢气和氧气反应生成水,将化学能转化为电能,其构造如图所示:a、b两个电极均由多孔的碳块组成。
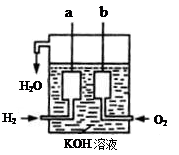
(1)a电极反应式是
(2)b电极反应式是
Ⅲ、如图表示一个电解池。X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液。
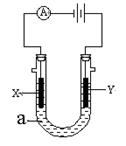
(1)X极上的电极反应式为 ,
在X极附近观察到的现象是 。
(2)Y极上的电极反应式为 ,
检验该电极反应产物的方法是 。
参考答案:Ⅰ(1) 小于(2) <(3) 143 kJ/g
Ⅱ、
本题解析:
试题分析:Ⅰ、(1)该反应正反应为放热反应,生成物的总能量小于反应物总能量。(2)气态水的能量高于液体水,故生成2mol气态水放出的热量小于572kJ。(3)值指1kg燃料完全燃烧放出的热量,由热化学方程式可知,1kg氢气燃烧放出的热量为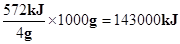 ,故氢气的热值为143kJ/g。
,故氢气的热值为143kJ/g。
Ⅱ、(1)a极通入H2,发生氧化反应,在碱性条件下生成水,电极反应式为:H2 + 2OH
本题难度:一般
4、选择题 下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)═2H2O(g)△H=-483.6?kJ?mol-1说明2?mol?H2(g)和1?mol?O2(g)的能量总和小于2?mol?H2O(g)的能量
B.已知C(s,石墨)═C(s,金刚石)△H>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4?kJ?mol-1,则含20?g?NaOH的稀溶液与稀盐酸完全中和,放出28.7?kJ的热量
D.已知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列热化学方程式书写正确的是(△H的绝对值均正确) [???? ]
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:C
本题解析:
本题难度:简单