微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
A.C + H2O ==CO + H2 ; ΔH==+131.3KJ·mol-1
B.C(s)+ H2O(g) ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol-1
C.C(s)+ H2O(l) ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol-1
D.C(s)+ H2O(g) ==CO(g) + H2(g) ; ΔH==+10.94KJ·mol-1
参考答案:B
本题解析:试题分析:反应吸热,则△H大于0。1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,则1mol碳即12g碳反应时吸收的能量是10.94kJ×12=131.3kJ,答案选B。
考点:考查热化学方程式的判断
点评:该题是基础性试题的考查,也是高考中的常见题型,难度不大。该题的关键是明确热化学方程式的含义以及书写的注意事项,然后灵活运用即可。有利于培养学生的规范答题能力。
本题难度:一般
2、选择题 下列各组物质中化学键的类型相同的是( )
A.HCl????MgCl2????NH4Cl
B.H2O?????Na2O?????CO2
C.CaCl2??NaOH?????H2O
D.NH3?????H2O??????CO2
参考答案:A.HCl中为共价键,MgCl2中为离子键,NH4Cl中既有
本题解析:
本题难度:一般
3、选择题 下列离子方程式与所述事实相符且正确的是
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3-
D.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-═Mn2++Cl2↑+2H2O
参考答案:B
本题解析:分析:A、Fe(OH)3溶于氢碘酸发生氧化还原反应生成亚铁离子和碘单质;
B、氢氧化铝不溶于弱酸,过量二氧化碳生成碳酸氢根离子;
C、漂白粉溶液在空气中失效是吸收空气中二氧化碳生成碳酸钙沉淀和次氯酸,次氯酸分解生成盐酸和氧气;
D、原子不守恒;
解答:A、Fe(OH)3溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2,故A错误;
B、氢氧化铝不溶于弱酸,过量二氧化碳生成碳酸氢根离子,离子方程式为Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;故B正确;
C、漂白粉溶液在空气中失效是吸收空气中二氧化碳生成碳酸钙沉淀和次氯酸,次氯酸分解生成盐酸和氧气Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓,故C错误;
D、用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O,故D错误;
故选B.
点评:本题考查了离子方程式书写方法和注意问题,主要考查氧化还原反应关系判断,氢氧化铝不溶于弱酸性质应用,离子方程式原子守恒分析,题目难度中等.
本题难度:一般
4、选择题 在25oC、1.01×105 Pa下,将2.2 g CO2通入75 mL 1 mol/L NaOH溶液中充分反应,测得反应放出x kJ 的热量.已知在该条件下,1 mol CO2通入1 L 2 mol/L NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)==NaHCO3(aq);ΔH=-(20y-x) kJ/mol
B.CO2(g)+NaOH(aq)==NaHCO3(aq);ΔH=-(4x-y) kJ/mol
C.CO2(g)+NaOH(aq)==NaHCO3(aq);ΔH=-(40x-y) kJ/mol
D.2CO2(g)+2NaOH(l)==2NaHCO3(l);ΔH=-(80x-20y) kJ/mol
参考答案:C
本题解析:2.2 g CO2是0.05mol,氢氧化钠是0.075mol,所以CO2和氢氧化钠反应的生成物是碳酸钠和碳酸氢钠,其物质的量都是0.025mol。又因为生成1mol碳酸钠放出的热量是ykJ,所以生成1mol碳酸氢钠放出的热量是(40x-y) kJ,因此答案是C。
本题难度:简单
5、填空题 (12分)(1)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想.“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是相同质量时,氢气放出的热量多,产物为水无污染。
已知:H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ/mol ; H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol ; H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:_______________________________.
(2)已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH=-176 kJ/mol
②NH3(g)+H2O(l)===NH3·H2O(aq) ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH= -72.3 kJ/mol
④NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l) ΔH=-52.3 kJ/mol
则NH4Cl(s)===NH4Cl(aq)的ΔH=______
(3)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
① 理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 __
② 假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容
c=4.18 J/(g·℃).为了计算中和热,实验时还需测量的数据有(填序号)__________;
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
③ 某学生实验记录数据如下:
实验
序号
| 起始温度t1/℃
| 终止温度t2/℃
|
盐酸
| 氢氧化钠
| 混合溶液
|
1
| 20.0
| 20.1
| 23.2
|
2
| 20.2
| 20.4
| 23.4
|
3
| 20.5
| 20.6
| 23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ __;
④假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”).
参考答案:(1) H2(l)+O2(l)===H2O(g);ΔH
本题解析:(1)考查盖斯定律的应用。根据①H2(g)+O2(g)=H2O(l)、②H2(g)=H2(l)、③O2(g)=O2(l)、④H2O(l)=H2O(g)可知,将①-②-③×1/2+④得到H2(l)+O2(l)===H2O(g),所以反应热是-285.8 kJ/mol+0.92 kJ/mol+3.42 kJ/mol+44.0 kJ/mol=-237.46 kJ/mol。
(2)②+③+④-①得到NH4Cl(s)===NH4Cl(aq),所以反应热是-35.1 kJ/mol -72.3 kJ/mol-52.3 kJ/mol+-176 kJ/mol=+16.3 kJ/mol。
(3)要计算放出的热量,就必须知道温度的变化量,以及溶液的质量。由于已经知道了密度和溶液的体积,所以不需要知道溶液的质量。利用体积和密度即可计算出质量。
(4)实验1、2、3中的温度差分别是23.2℃-20.05℃=3.15℃、23.4℃-20.3℃=3.1℃、23.6℃-20.55℃=3.05℃,其平均值是3.1℃,所以反应热是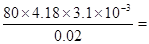 -51.8 kJ/mol。参加的反应的盐酸和氢氧化钠的体积发生了变化,所以放出的热量会变化,但中和热是不变的。 -51.8 kJ/mol。参加的反应的盐酸和氢氧化钠的体积发生了变化,所以放出的热量会变化,但中和热是不变的。
本题难度:一般
|