微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学课 外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
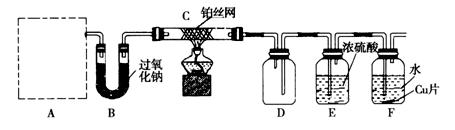
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________________(填代表备选试剂的序号);此时A中主要的玻璃仪器有__________________________________(填名称)。
(2)下面关于A中所用试剂的说法正确的是___________________。
A.施用该物质会大大提高粮食产量而对环境无影响
B.向该物质的溶液中加入足量氢氧化钡溶液发生反应的离子方程式为:NH4+ + OH– = NH3?H2O
C.可通过加热方法区别该试剂和(NH4)2SO4
D.工业上用NH3等合成该物质的过程可称为氮的固定
(3)装置C中发生催化氧化反应的化学方程式为_________________________,装置E发生反应的化学方程式为_________________________________________________。
(4)假设A、B中的药品充足,则装置F中可以观察到的现象有________________________
___________________________________________________________________ __。
__。
(5)指导老师从安全与环保角度考虑,指出该装置有两处明显的缺陷,请你提出修改建议:_____________________________________________________________________________________ ____________________________________________________________。
____________________________________________________________。
参考答案:(1) NH4HCO3(2分)??试管、酒精灯(2分)???
本题解析:略
本题难度:一般
2、实验题 (13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2??(1)
平均反应速率的计算式为v(S2O82-)=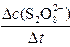 。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="?" S4O62-+ 2I-??(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
实?验?编?号
| ①
| ②
| ③
| ④
| ⑤
|
?
试剂
用量
(mL)
| 0.20? mol·L-1(NH4)2S2O8溶液
| 20.0
| 10.0
| ?b
| 20.0
| 20.0
|
0.20? mol·L-1 KI溶液
| 20.0
| 20.0
| 20.0
| 10.0
| 5.0
|
0.010? mol·L-1 Na2S2O3溶液
| ?a
| 8.0
| 8.0
| 8.0
| 8.0
|
0.2% 淀粉溶液
| 2.0
| 2.0
| 2.0
| 2.0
| 2.0
|
0.20? mol·L-1KNO3溶液
| 0
| 0
| 0
| 10.0
| ?c
|
0.20? mol·L-1(NH4)2SO4溶液
| 0
| 10.0
| 15.0
| 0
| 0
|
20 ℃时,反应时间Δt(s)
| 32
| 67
| 130
| 66
| 135
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变
|
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是??????????。
(3)第①组实验的v(S2O82-)=????????????????????mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)?????????????????????
???????????????????????????????????????????????????????????????????????????。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
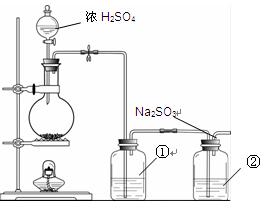
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
①????????????????????????????????;
②????????????????????????????????。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是?????????????????????????????????????????????。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:???????????????????????????????????????????????????????????????????。
参考答案:(13分)
I(1)a? 8.0?(1分)?????
本题解析:略
本题难度:简单
3、填空题 某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
(1)制备硫酸亚铁溶液,最合适的试剂组为___________(填编号);
a.过量铁屑和稀硫酸????b.过量稀硫酸和铁屑?????c.过量硫酸铁溶液和铁屑
(2)实验室保存硫酸亚铁溶液的一般方法是_____________________________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
烧杯编号
| ①
| ②
| ③
|
加入试剂
| 铁粉0.1g
| 铁粉0.1g,0.1mol/LH2SO43mL
| 0.1mol/LH2SO43mL
|
红色出现时间(天)
| 1天
| 4天左右
| 8天以上
(3)在烧杯②中加入2种试剂后,即可观察到的现象为_____________________________;
(4)通过比较上述3组实验,可以得出的结论为___________________________________;
(5)硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
①试用一个离子方程式表示上述反应过程中的变化_________________________;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因____________________________________________________。
参考答案:(1)a(2分)
(2)加入铁钉(或铁屑,合理即可)(
本题解析:略
本题难度:一般
4、实验题 (17分)铁不能与冷水反应,但能与水蒸气反应,某化学兴趣小组为探究铁与水蒸气反应,请你为他们完成实验报告。
实验目的:探究铁与水蒸气的反应
反应原理:???????????????????????????????????????(用化学反应方程式表示)
实验装置:回答以下问题(加热装置略去)
|