微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)温室效应和资源短缺 等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
参考答案:
本题解析:
本题难度:一般
2、选择题 一定温度下在容积恒定的密闭容器中,进行反应A(s)+2B(g) 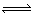 C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体总物质的量 ④B物质的量浓度
A.①④
B.只有②③
C.②③④
D.只有④
参考答案:A
本题解析:
试题分析:①由于气体的质量会发生变化,所以若混合气体的密度不变,则反应达到平衡,正确;②由于该反应是在恒容的密闭容器内进行的反应前后气体的体积相等的反应,所以无论反应是否达到平衡,容器内气体的压强不变,因此不能判断反应达到平衡,错误;③由于该反应是反应前后气体体积相等的反应,所以无论反应是否达到平衡,混合气体总物质的量不变,正确;④B是气体,若反应未达到平衡,则B的物质的量浓度就会发生变化,所以B物质的量浓度不变说明反应达到平衡状态,正确。因此选项是A。
考点:考查可逆反应达到平衡状态的判断的知识。
本题难度:一般
3、填空题 (本题共13分)氨的催化氧化是工业制硝酸的重要反应,500°C,其反应方程式为:
4NH3(g) +5O2(g) 4NO(g)+6H2O(g)+Q,完成下列填空:
4NO(g)+6H2O(g)+Q,完成下列填空:
23.如果要提高上述反应的反应速率,可以采取的措施是
a.减压 b.增加NH3的浓度 c.升温 d.将水液化移走
24.在500℃时,在2L密闭容器中加入10mol NH3、10mol O2,上述可逆反应达到平衡,过程如图所示,在a时刻改变反应条件,重新达到平衡,该改变的条件可能是 ,比较b时刻与c时刻反应氨的转化率大小(填“>”或“<”)b c。其它条件不变,c时刻加压后,若平衡正向移动,其原因可能是 ,若在d时刻重新达到平衡,请在图中画出c到d的相关变化图像。

25.工业上以氨和空气为原料生产硝酸,请画出硝酸工业的物质流程图。
26.氨中氮元素原子最外层电子排布的轨道表达式是 ,短周期元素原子所形成的与N3-电子排布相同的离子所对应的原子的半径从大到小的排列顺序为 。其中非金属元素形成的氢化物的稳定性由强到弱为的顺序为(用化学式表示) 。
27.已知NH3与N2H4都是氮的氢化物,N2H4的电子式是 。NH3与N2H4都具有还原性,可以与其它强氧化剂反应,例如在一定条件下,氨可以被双氧水氧化为游离态氮,写出该反应的化学方程式 。
参考答案:(23题2分,25题2分,其余每空1分)23.bc
本题解析:
试题分析:23.a.减压反应速率减小,a错误;b.增加NH3的浓度反应速率加快,b正确;c.升温反应速率加快,c正确;d.将水液化移走,降低生成物浓度,反应速率降低,d错误,答案选bc。
24.在500℃时,在2L密闭容器中加入10mol NH3、10mol O2,上述可逆反应达到平衡,过程如图所示,
根据图像可知在a时刻正逆反应速率均瞬间增大,当逆反应速率大于正反应速率说明平衡向逆反应方向进行。由于正反应是体积增大的放热反应,则改变的反应条件是升高温度或增大压强;根据图像可判断b→c的过程中正反应方向大于逆反应速率,即反应向正反应方向进行,则反应氨的转化率是b<c。其它条件不变,c时刻加压后,若平衡正向移动,这说明正反应体积减小,因此其原因可能是可能加压后水被液化。根据上述分析可知c到d的相关变化图像可以表示为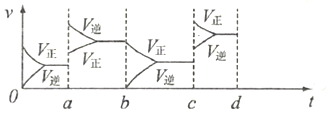 。
。
25.氨气首先发生催化氧化生成NO,然后NO被氧化生成NO2,NO2溶于水转化为硝酸,则硝酸工业的物质流程图可表示为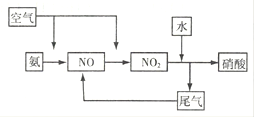 。
。
26.氮元素的原子序数是7,则氮元素原子最外层电子排布的轨道表达式是 ;同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则短周期元素原子所形成的与N3-电子排布相同的离子所对应的原子的半径从大到小的排列顺序为Na>Mg>Al>O>F;非金属性越强,氢化物的稳定性越强,则氢化物稳定性强弱顺序是HF>H2O>NH3。
;同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则短周期元素原子所形成的与N3-电子排布相同的离子所对应的原子的半径从大到小的排列顺序为Na>Mg>Al>O>F;非金属性越强,氢化物的稳定性越强,则氢化物稳定性强弱顺序是HF>H2O>NH3。
27.已知NH3与N2H4都是氮的氢化物,因此可以看作是氨气分子中的一个氢原子被氨基取代,则N2H4的电子式是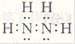 。在一定条件下,氨可以被双氧水氧化为游离态氮,即产生氮气,根据原子守恒可知还有水生成,则该反应的化学方程式为2NH3+3H2O2→N2+ 6H2O。
。在一定条件下,氨可以被双氧水氧化为游离态氮,即产生氮气,根据原子守恒可知还有水生成,则该反应的化学方程式为2NH3+3H2O2→N2+ 6H2O。
考点:考查外界条件对反应速率和平衡状态的影响以及元素周期律、物质结构的有关判断
本题难度:困难
4、填空题 单质碘与红磷在常温下混合不反应,但滴入几滴水后能剧烈反应,生成HI和H3PO3。但实验室制取氢碘酸的方法是把H2S通入I2水中,过滤生成的硫,可得质量分数为50%的氢碘酸
(1)写出实验室制取氢碘酸的化学方程式______________________;
(2)氢碘酸在空气中放置易易氧化变质,写出可能发生反应的化学方程式___________________________;
(3)为防止氢碘酸在空气中氧化变质,可在氢碘酸中加入少量___________,写出有关反应的化学方程式__________________________。??????
(4)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
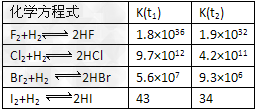
①已知t2>t1,HX的生成反应是__________?反应(填“吸热”或“放热”)。
②共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是_______________。
③仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_________________(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱????
d.HX的稳定性逐渐减弱
参考答案:(1)I2+H2S==2HI+S↓
(2)4HI+O2
本题解析:
本题难度:一般
5、填空题 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)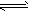 Fe(s)+CO2(g)△H>0。
Fe(s)+CO2(g)△H>0。
(1)其平衡常数可表示为______________, 温度降低,化学平衡移动后达到新的平衡,高炉内CO2和
CO的体积比值____,平衡常数K值_____(本小题空格均备选:增大、减小或不变)
(2)已知1100℃时K=0.263。1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态____(选填“是”或“否”),此时,化学反应速率是
υ正___υ逆(选填“大于”、“小于”或“等于”),其原因是___________。
参考答案:(1)c(CO2)/c(CO);减小;减小
(2)否;
本题解析:
本题难度:一般