微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 可逆反应aA(g)+bB(g)

cC(g)+dD(g),试据图Ⅰ、图Ⅱ回答下列问题:
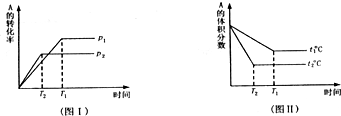
(1)压强p1比p2______(填“大”或“小”)??
(2)(a+b)比(c+d)______(填“大”或“小”)
(3)温度t1比t2______(填“高”或“低”)?
(4)正反应是______热反应.
参考答案:(1)压强越大,反应速率越大,反应达到平衡时用的时间越少,由
本题解析:
本题难度:一般
2、填空题 现有反应:CO(g)+H2O(g)?CO2(g)+H2(g)(放热)在85手k时,k=大.
(大)若升温至95手℃,达平衡时k______大(填“大于”“小于”“等于”)
(2)85手℃时,在固定容积的密闭容器中,放入混合物,起始浓渡C(co)=手.大mol/L,C(H2O)=手.3mol/L,C(CO2)=手.大mol/L,C(H2)=手.5mol/L,则反应开始时,H2O消耗速率比生成速率______(填“大”、“小”或“不能确定”)
(3)保持温度不变,容器的体积不变,当往容器中充入适量的H2S气体,则重新达到平衡时,CO的反应速率比充入H2S气体之前______(填“增大”、“减小”或“不能确定”)理由是______.
参考答案:(1)升高温度到950℃,对于正向放热的反应而言,平衡向逆反
本题解析:
本题难度:简单
3、简答题 已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200
平衡常数
1.7
1.1
1.0
0.6
0.4
回答下列问题:
(1)该反应的平衡常数表达式K=______,△H______0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1.,则6s时c(A)=______?mol?L-1,C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为______,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为______;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变????b.气体的密度不随时间改变
c.c(A)不随时问改变?????d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为______.
参考答案:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常
本题解析:
本题难度:一般
4、选择题 已知:2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4的混合气体通入恒温密闭容器中,反应体系中物质浓度随时间的变化关系如图所示.下列说法正确的是( ) 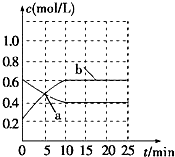
A.a点表示反应处于平衡状态
B.25?min末,若增大压强,化学平衡常数增大
C.25?min末,若升高温度,化学平衡常数不变
D.10min内用N2O4表示的平均反应速率为0.02mol?L-1?min-1
参考答案:D
本题解析:
本题难度:简单
5、简答题 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L?及?c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②______;______.
③______;______.
(2)实验②平衡时B的转化率为______;实验③平衡时C的浓度为______;
(3)该反应的△H______0,其判断理由是______
(4)该反应进行到4.0min时的平均反应速率:
实验②:vB=______
实验③:vc=______.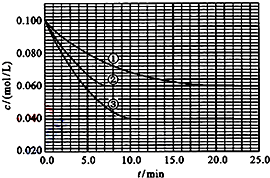
参考答案:(1)与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应
本题解析:
本题难度:一般
|