微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数,下列说法中正确的是
A.O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA
B.将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.标准状况下11.2LCl2溶于1L水中,转移电子的数目为0.5NA
参考答案:A
本题解析:
试题分析:A、氧气和臭氧都是由氧原子构成的。因此在该题中的氧原子的物质的量为氧气和臭氧的总质量除以氧原子的摩尔质量,为0.4mol,所以正确;B、将标准状况下22.4LNO与11.2LO2混合后若完全反应生成二氧化氮,体积约为22.4L,但是二氧化氮与四氧化二氮之间存在一个转化平衡,所以生成的气体的总体积小于22.4L,错误;C、每生成4molCl2转移的电子数为7NA,错误;D、氯气与水的反应是一个可逆反应,不可以完全转化为盐酸和次氯酸,错误。
本题难度:一般
2、选择题 质量相等的下列物质中,含分子数最多的是 ( )
A.CH4
B.O2
C.NH3
D.CO
参考答案:A
本题解析:
试题分析:根据阿伏加德罗定律可知,气体的物质的量越大,含有的分子数越多。由于四种气体的质量相等,所以根据n=m/M可知,气体的摩尔质量越小,物质的量越大,甲烷的摩尔质量最小,甲烷的物质的量最大,体积最大,答案选A。
考点:考查物质的量的有关计算
点评:在利用阿伏加德罗定律时,需要注意的是该定律只能适用于气体体系,包括混合物气体,而不能适用于固体或液体。
本题难度:一般
3、选择题 硫酸铝、硫酸钾、明矾三种物质组成的混合物中,当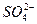 的浓度为0.20 mol·L-1时,加入等体积的0.20 mol·L-1的KOH溶液(混合后溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么最后混合物中K+的浓度是(???)
的浓度为0.20 mol·L-1时,加入等体积的0.20 mol·L-1的KOH溶液(混合后溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么最后混合物中K+的浓度是(???)
A.0.20 mol·L-1
B.0.25 mol·L-1
C.0.225 mol·L-1
D.0.45 mol·L-1
参考答案:C
本题解析:设原溶液为1 L,其中有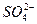 ?0.20 mol;由Al3+与OH-的反应关系可得原溶液中所含有的Al3+为0.05 mol,最后的溶液中,所含的溶质为K2SO4和KAlO2,它们的物质的量分别是0.20 mol和0.05 mol,则K+的总量为0.20 mol×2+0.05 mol="0.45" mol,c(K+)
?0.20 mol;由Al3+与OH-的反应关系可得原溶液中所含有的Al3+为0.05 mol,最后的溶液中,所含的溶质为K2SO4和KAlO2,它们的物质的量分别是0.20 mol和0.05 mol,则K+的总量为0.20 mol×2+0.05 mol="0.45" mol,c(K+)
本题难度:简单
4、计算题 (1)现有500mL物质的量浓度为1mol/L的NaOH溶液,与足量的铝完全反应,可消耗多少克铝?
(2)若产生标准状况下11.2L的H2,转移多少mol电子?
参考答案:(1)13.5????????(2)1mol
本题解析:
试题分析:2Al+2NaOH+2H2O=2NaAlO2+3H2
2?????2
X?? 0.5L×1mol/L????????解得:X=0.5mol
m(Al)=0.5mol×27g/mol=13.5g
(2)若产生标准状况下11.2L的H2,则0.5mol,转移的电子即为1mo
本题难度:一般
5、选择题 在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为 [???? ]
A.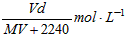
B.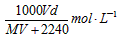
C.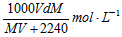
D.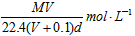
参考答案:B
本题解析:
本题难度:简单