125a
54V
mol/L
参考答案:V?mL?Al2(SO4)3溶液中含有Al3+a?g,则1/
本题解析:
本题难度:一般
2、填空题 (1)将质量比为14︰15的N2和NO混合,混合气体中N2和NO的物质的量之比为________;氮原子和氧原子的个数之比为_______;该混合气体的平均摩尔质量为_______?。
(2)23.75g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为________;则MCl2的相对分子质量为______?;M的相对原子质量为___________。
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则(NOx)的摩尔质量为________;x的数值为_________。
参考答案:(1)1︰1;?3︰1;??
(2)95g/mol;?
本题解析:
本题难度:一般
3、选择题 配制100mL 1mol/LNaOH溶液,下列操作中正确的是
A.在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.用蒸馏水洗涤烧杯、玻璃棒2---3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹面恰好与刻度相切
参考答案:C
本题解析:
解决本题学生应有较好的实验技能。
A:中称量NaOH应放在烧杯中。
B:超过容量瓶刻度线后实验失败,应重做。
C:正确,洗涤可以防止溶质的非正常损失。
D:加蒸馏水时应在离刻度线1-2厘米时改用胶头滴管;加水到水平观察凹面最低处刚好与刻度线相切。
本题难度:一般
4、选择题 与100 mL,2 mol/L的AlCl3溶液中Cl-的物质的量浓度相等的是( )。
A.3 mL 2 mol/L的NaCl溶液
B.50 mL 4 mol/L的FeCl3溶液
C.200 mL 1mol/L的HCl溶液
D.50 mL 3 mol/L的BaCl2溶液
参考答案:D
本题解析:
试题分析:100 mL,2 mol/L的AlCl3溶液中Cl-的物质的量浓度是2mol/L×3=6mol/L。A、3 mL 2 mol/L的NaCl溶液中Cl-的物质的量浓度是2mol/L,错误;B、50 mL 4 mol/L的FeCl3溶液中Cl-的物质的量浓度是4mol/L×3=12mol/L,错误;C、200 mL 1mol/L的HCl溶液中Cl-的物质的量浓度是1mol/L,错误;D、50 mL 3 mol/L的BaCl2溶液中Cl-的物质的量浓度是3mol/L×2=6mol/L,正确,答案选D。
考点:考查溶液中离子浓度的计算
本题难度:一般
5、计算题 19.2g Cu与过量的50 mL 18 mol·L-1浓硫酸加热完全反应后,
反应方程式如下: Cu + 2H2SO4(浓)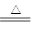 CuSO4?+ SO2↑+ 2H2O 。 CuSO4?+ SO2↑+ 2H2O 。
(1)得到SO2气体的体积(标准状况下)是??????????????????????L;
(2)若反应后溶液中加入水至溶液的体积为500mL,取出50mL,那么50mL溶液中CuSO4?的物质的量浓度为???????????mol·L-1;
(3)往反应后溶液中加入足量的BaCl2,可以生成硫酸钡沉淀为?????????????g。
参考答案:(1)6. 72?????????(2) 0.6 ?????
本题解析:
试题分析:19.2gCu为0.3mol,与足量浓硫酸生成0.3molSO2;同时生成0.3molCuSO4,将溶液稀释至500mL,物质的量浓度为0.6mol/L;反应后溶液中SO42-物质的量为(0.05×18-0.3)mol=0.6mol,向反应后的溶液中加入足量氯化钡溶液生成硫酸钡0.6mol。
点评:本题(3)应用元素守恒的思想。反应前硫总物质的量为0.9mol,生成SO2中S为0.3mol,所以残留溶液中SO42-为0.6mol。
本题难度:一般
|