微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 用98%(密度为1.84g/cm3)的浓硫酸配制3mol/L的稀硫酸100ml.回答下列问题:
(1)需要用量筒量取浓硫酸______ml.
(2)配制操作可分解成如下几步,正确的操作顺序是______
A.根据计算,用量筒取一定体积的浓硫酸
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.将冷却的稀硫酸注入已检查不漏水的容量瓶中
D.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
E.盖上容量瓶塞子,振荡,摇匀
F.用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
G.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1-2cm
(3)由于错误操作,使制得的稀硫酸溶液浓度偏小的是______(填写编号).
A.用量筒量取一定液体时,俯视液面读数
B.使用容量瓶配制溶液时,俯视液面定容后所得溶液浓度
C.没有用蒸馏水洗涤烧杯2~3次,并将溶液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有烘干
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配制好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用.
参考答案:(1)98%(密度为1.84g/cm3)的浓硫酸的物质的量浓
本题解析:
本题难度:一般
2、填空题 200 mL 0.2 mol/L和100 mL 0.5 mol/L的两种盐酸混合,设得到300 mL盐酸,其物质的量浓度是
_______。若所得盐酸的密度为1. 004 g/cm3,则其溶质的质量分数是___________。
参考答案:0.3mol/L;1.09%
本题解析:
本题难度:一般
3、简答题 某进行无土栽培试验的实验室需要配制两份成分完全相同的某营养液,其配方如下表.
| KCl | K2SO4 | ZnSO4
0.3mol
0.2mol
0.1mol
但实验员配完第一份溶液时发现,实验室的ZnSO4已经用完了,锌盐中只剩下了硝酸锌〔Zn(NO3)2〕、氯化锌(ZnCl2),选择现有药品帮实验员配得第二份营养液,写出所取药品的物质的量.
参考答案:原配方营养液中:n(K+)=n(KCl)+2n(K2SO4)
本题解析:
本题难度:一般
4、填空题 (12分)填空题
(1)金属钙在一定条件下可以与氢气化合生成CaH2(白色固体)。将该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红。请根据以上事实书写CaH2与水反应的化学方程式_____________________________________。
(2)实验室可用MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制备氯气,请回答以下问题: MnCl2+Cl2↑+2H2O制备氯气,请回答以下问题:
①该反应的还原剂是 ,氧化剂与还原剂的物质的量比是______________。被氧化的元素是_______________,还原产物是 。
②若反应中转移了NA个电子,则生成的Cl2在标准状况下的体积是 。
③实验室用12.00 mol/L盐酸配制100mL 1 mol/L 盐酸,需要的玻璃仪器除了烧杯、量筒、玻璃棒,还有____________。若定容时俯视刻度线,则配得溶液的浓度___________(填“偏高”,“偏低”,“不变”)。
参考答案:(1)CaH2 + 2H2O = Ca(OH)2 + 2H2
本题解析:
试题分析:(1)根据现象分析,溶液变红,说明有碱性物质生成,有气泡生成说明有气体生成,氢化钙中的氢元素化合价为-1,和水的氢元素+1发生氧化还原反应生成氢气,所以氢化钙和水反应生成氢氧化钙和氢气,方程式为:CaH2 + 2H2O = Ca(OH)2 + 2H2↑。(2)①反应中盐酸中的氯元素化合价升高,做还原剂,二氧化锰中的锰元素化合价降低,每摩尔二氧化锰得电子需要2摩尔盐酸失去电子,所以氧化剂和还原剂的物质的量比为1:2;盐酸中的氯元素化合价升高被氧化,二氧化锰中锰元素化合价降低,被还原生成氯化锰是还原产物。②每生成1摩尔氯气转移2摩尔电子,所以转移1摩尔电子时生成0.5摩尔氯气,标准状况下体积为11.2L。③配制100毫升溶液必须用100mL容量瓶还用胶头滴管;定容时俯视,溶液的体积偏小,则配制的浓度偏高。
考点:氯气的制取,一定物质的量浓度的溶液的配制。
本题难度:一般
5、选择题 体积为VmL,密度为dg/cm3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol/L,质量分数为ω%,下列表达式中正确的是
[???? ]
A.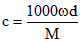
B.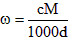
C.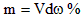
D. 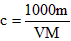
参考答案:CD
本题解析:
本题难度:一般
|