微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过
B.在铁上镀锌时,锌棒作阳极,且电解液硫酸锌的浓度是不变的
C.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1: 2
D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
2、选择题 下列关于如图所示装置的叙述中正确的是

A.可将电能转化为化学能
B.铜是正极,铜片上有气泡产生
C.电流从锌片经导线流向铜片
D.氢离子在锌片表面被还原
3、填空题 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,Ag2CrO4为砖红色沉淀。
(1) AgCl、AgI、 Ag2CrO4三种饱和溶液中,Ag+浓度由大到小顺序是 。现将等体积2.0×10—4 mol·L-1的AgNO3溶液和一定浓度的Na2CrO4溶液混合,若要产生Ag2CrO4沉淀,则Na2CrO4溶液至少浓度为 mol·L-1。
(2) 在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,该平衡转化的离子方程式为 。Na2Cr2O7可用来鉴别NaCl和NaNO2,鉴别时发生的离子方程式为 。
(3) 工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式: ,Cr2O72-转化为毒性较低的Cr3+的离子方程式为: 。
(4) 用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。可滴入几滴 溶液为指示剂,滴定的终点现象为 。
4、填空题 (1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置实现上述过程:
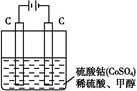
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极反应式: 。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:
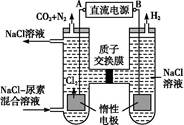
①电源的负极为 (填“A”或“B”)。
②阳极室中发生的反应依次为 。
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g (忽略气体的溶解)。
5、简答题 实验活动课上,学生从废旧干电池中回收碳棒、锌皮、二氧化锰、氯化铵、氯化锌等主要物质.
(1)二氧化锰的作用是与正极上的产物(H2)反应,生成Mn2O3,写出该反应的化学方程式:______.
(2)得到氯化铵和氯化锌的晶体混合物后,检验其中含有NH4+的方法是______;
(3)学生将洗净的碳棒和锌皮堆放在一起晾干,一段时间后,发现锌皮上出现锈斑,用电极反应式阐明原因:______.