微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80 ℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是___________________,加热的作用是
_________________________。
(2)实验步骤②明显不合理,理由是
________________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_________________;
__________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
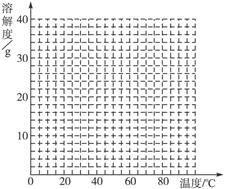
硫酸亚铁的溶解度和析出晶体的组成
温度/℃
| 0
| 10
| 30
| 50
| 56.7
| 60
| 64
| 70
| 80
| 90
|
溶解度/g
| 14.0
| 17.0
| 25.0
| 33.0
| 35.2
| 35.3
| 35.6
| 33.0
| 30.5
| 27.0
|
析出晶体
| FeSO4·7H2O
| FeSO4·4H2O
| FeSO4·H2O
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
2、填空题 已知A~I均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中需要或生成的水及其他部分产物已略去。请回答以下问题:
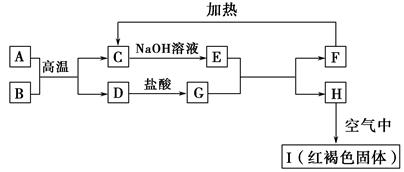
(1)B和F分别是???????????????(填化学式)。
(2)写出下列反应的化学方程式:
①A与B在高温下反应:???????????????????????????????。
②H在空气中转变为I:???????????????????????????????。
(3)E溶液中所有离子浓度由大到小的顺序是???????。
(4)用离子反应方程式表示G溶液呈酸性的原因??????????????????????????????????;该反应的平衡常数为???????(已知常温下,H的溶度积常数Ksp=8.0×10-16)。
3、选择题 等质量的铜片在酒精灯上热后,分别插入下列液体中,放置片刻后取出,铜片质量不变的是(???)
A.盐酸
B.无水乙醇
C.冰醋酸
D.乙醛
4、实验题 某研究性学习小组在研究由Fe2+制备Fe(OH)2的 过程中,设计了如下实验方案: 过程中,设计了如下实验方案:
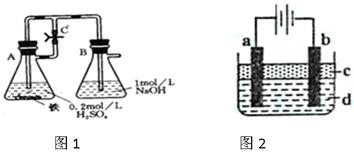
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:???????????????????????????????????????
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水?②NaCl溶液?③NaOH溶液?④四氯化碳?⑤CuCl2溶液?⑥乙醇?⑦Fe棒?⑧植物油?⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
5、填空题 I.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是??????????;实验室在配制FeSO4溶液时常加入?????以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化?????????????。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是??????????。
②计算上述产品中FeSO4·7H2O的质量分数为??????????。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因??????????。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是??????????。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为??????????。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为??????????(用离子方程式表示)
|