FeSO4·H2O
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
参考答案:(1)除油污?升高温度,溶液碱性增强,去油污能力增强
本题解析:(1)Na2CO3溶液的主要作用是除去废铁屑表面的油污,因为升高温度,Na2CO3的水解程度大,去污能力强,故需加热。
(2)Fe2+易被空气中的O2氧化成Fe3+,要保证得到较纯净的FeSO4·7H2O晶体,必须在溶解 铁屑时保证铁屑过量。
(3)要得到纯净的FeSO4·7H2O晶体,在滤出晶体后必须洗涤2~3次,以除去其表面的杂质离子。
本题难度:简单
2、填空题 已知A~I均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中需要或生成的水及其他部分产物已略去。请回答以下问题:
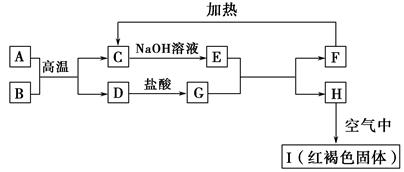
(1)B和F分别是???????????????(填化学式)。
(2)写出下列反应的化学方程式:
①A与B在高温下反应:???????????????????????????????。
②H在空气中转变为I:???????????????????????????????。
(3)E溶液中所有离子浓度由大到小的顺序是???????。
(4)用离子反应方程式表示G溶液呈酸性的原因??????????????????????????????????;该反应的平衡常数为???????(已知常温下,H的溶度积常数Ksp=8.0×10-16)。
参考答案:(1)Fe2O3、Al(OH)3
(2)①Fe2O3+
本题解析:本题以无机框图为载体,考查无机物的性质及化学反应原理,意在考查考生的综合分析能力。(1)根据框中转化关系及题干信息,可以确定I为氢氧化铁。A、D为金属单质,根据A和B的反应条件就可以联想到铝热反应,推测A、D为铝和铁,即A为铝,B为氧化铁,C为氧化铝,D为铁,E为偏铝酸钠,G为氯化亚铁,F为氢氧化铝,H为氢氧化亚铁,I为氢氧化铁。偏铝酸钠水解使溶液呈碱性,所以溶液中离子浓度的大小顺序为c(Na+)>c(AlO2-)>c(OH-)>c(H+);FeCl2溶液中,Fe2+发生水解:Fe2++2H2O![]()
本题难度:一般
3、选择题 等质量的铜片在酒精灯上热后,分别插入下列液体中,放置片刻后取出,铜片质量不变的是(???)
A.盐酸
B.无水乙醇
C.冰醋酸
D.乙醛
参考答案:B
本题解析:略
本题难度:简单
4、实验题 某研究性学习小组在研究由Fe2+制备Fe(OH)2的 过程中,设计了如下实验方案: 过程中,设计了如下实验方案:
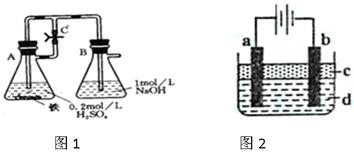
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:???????????????????????????????????????
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水?②NaCl溶液?③NaOH溶液?④四氯化碳?⑤CuCl2溶液?⑥乙醇?⑦Fe棒?⑧植物油?⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
参考答案:方法 本题解析:略 本题解析:略
本题难度:一般
5、填空题 I.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是??????????;实验室在配制FeSO4溶液时常加入?????以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化?????????????。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是??????????。
②计算上述产品中FeSO4·7H2O的质量分数为??????????。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因??????????。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是??????????。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为??????????。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为??????????(用离子方程式表示)
参考答案:(16分)I.(1)12Fe2++3O2+6H2O=4Fe(
本题解析:
试题分析: I.(1)亚铁离子具有还原性,极易被氧化生成铁离子,进而生成氢氧化铁沉淀,反应的离子方程式是12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+;由于亚铁离子极易被氧化生成铁离子,所以实验室在配制FeSO4溶液时常加入铁粉以防止其被氧化;亚铁离子易被氧化生成铁离子,可以通过检验铁离子来检验硫酸亚铁是否被氧化,即取少量FeSO4溶液置于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO4溶液已被氧化,如不变红,则说明FeSO4溶液没有被氧化。
(2)①由于酸性高锰酸
本题难度:一般
|