微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA代表阿伏加德罗常数,下列说法一定正确的是
A.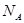 个氢气分子所占的体积为22.4L
个氢气分子所占的体积为22.4L
B.40g烧碱溶于1L水中所得溶液中溶质的物质的量浓度等于1mol/L
C.1L 0.1mol/L 的NaCl溶液中,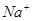 与
与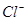 离子总数为
离子总数为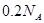
D.同温同压时,相同体积的任何气体所含的原子数一定相同
参考答案:C
本题解析:
试题分析:A、没有指明氢气所在的温度和压强,即没有指明是在标准状况下,所以不能得知氢气的体积,故不选A;B、烧碱溶于水中,没有说明溶液的体积,不能计算溶质的物质的量浓度,故不选B;C、在氯化钠溶液中钠离子为0.1摩尔,氯离子为0.1摩尔,故离子总数为0.2摩尔,即0.2NA,故选C;D、同温同压时,相同体积的任何气体的物质的量相同,但由于气体分子中含有的原子数可能不同,所以相同物质的量的气体含有的原子数不一定相同,故不选D。
考点:阿伏伽德罗常数。
本题难度:一般
2、选择题 标准状况下,将V L气体(摩尔质量为M g/mol)溶于0.2L水中,所得溶液的密度是a g/cm3,则此溶液的物质的量浓度(mol/L)为
A.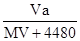
B.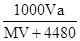
C.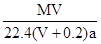
D.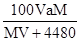
参考答案:B
本题解析:标准状况下,将V L气体的物质的量为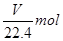 ,其质量为
,其质量为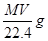 ;所以溶液的质量分数为
;所以溶液的质量分数为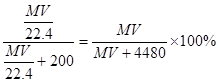 ;根据物质的量的浓度与质量分数的关系可得:
;根据物质的量的浓度与质量分数的关系可得: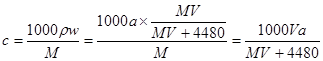 mol/L
mol/L
本题难度:一般
3、选择题 等物质的量的CH4和NH3相比较,下列结论不正确的是( )
A.原子个数之比为5:4
B.氢原子个数之比为4:3
C.分子个数之比为16:17
D.质量比为16:17
参考答案:A.原子个数比等于物质的量之比,为5:4,故A正确;
本题解析:
本题难度:简单
4、选择题 在无土栽培中需用浓度为0.5mol/LNH4Cl、0.16mol/LKCl、0.24mol/LK2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是?
A.0.4mol、0.5mol、0.12mol
B.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24mol
D.0.64mol、0.02mol、0.24mol
参考答案:D
本题解析:0.5mol/LNH4Cl、0.16mol/LKCl、0.24mol/LK2SO4的混合溶液,设溶液体积为1L,所含离子的物质的量为NH4+:0.5mol,K+:0.64mol,Cl-:0.56mol,SO42-:0.24mol,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,需用0.64mol KCl、0.02molNH4Cl、0.24mol(NH4)2SO4,故选D
本题难度:一般
5、填空题 (6分)照相底片的感光材料上含有一层AgBr胶体粒子的明胶,照相感光过程中,在光的作用下,AgBr分解成“银核” AgBr→Ag+Br 显影时,感光材料经过显影液作用,含有银核的AgBr粒子被还原为金属银,成为黑色成像,而大量未感光的AgBr粒子在定影时,与定影液中的硫代硫酸钠(Na2S2O3)反应形成 [Ag(S2O3)2]3-络离子而溶解于定影液中:
Ag+ + 2S2O32-= [Ag(S2O3)2]3-
本实验采用简单的化学沉淀方法从废定影液中回收银的方法。其原理是在废定影液中加入硫化钠与定影液中的络离子中的银转化为Ag2S沉淀,并使定影液再生,;再将硫化银送至高温炉灼烧,硫化银就分解为单质银和二氧化硫气体,就达到回收银的目的。
(1)写出Na2S与Na3[Ag(S2O3)2]反应的化学方程式
(2)如果废定影液中含银量为5.68g.L-1 试计算2升废定影液中至少加入Na2S的物质的量是 。(保留小数点后四位数)
参考答案:(1)Na2S+2Na3[Ag(S2O3)2]= Ag2S↓
本题解析:(1)根据生成物有硫化银可知,方程式为Na2S+2Na3[Ag(S2O3)2]= Ag2S↓+ 4Na2S2O3。
(2)2升废定影液中含有银是5.68g.L-1×2L=11.36g,物质的量是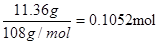 。所以硫化银的化学式可知,需要硫化钠的物质的量是
。所以硫化银的化学式可知,需要硫化钠的物质的量是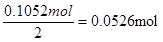 。
。
本题难度:困难