微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 航天飞机常用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4等可燃物质与O2-起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为
CH4+2O2+2OH-==CO32-+3H2O。
(1)负极上的电极反应为_________________________。
(2)消耗16.8 L(标准状况下)O2时,有_________mol电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度_________(填“增大”、“减小”或“不变”)。
2、选择题 锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池.?某种锂电池的总反应式是Li+MnO2=LiMnO2.下列说法正确的是( )
A.Li是负极,电极反应为Li-e-=Li+
B.Li是正极,电极反应为Li+e-=Li-
C.MnO2是负极,电极反应为MnO2+e-=MnO2-
D.锂电池是一种非环保型电池
3、选择题 下列有关电池的说法不正确的是[???? ]
A.手机上用的锂离子电池属于二次电池 ??
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 ??
C.甲醇燃料电池可把化学能转化为电能 ??
D.锌锰干电池中,锌电极是负极
4、填空题 (12分)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ,则甲醇燃烧的热化学方程式为????????????????????????????????????????????????????????。
(2)甲醇燃料电池的结构示意图如下左图。甲醇进入???????极(填“正”或“负”),正极发生的电极反应为????????????????????????????????????。
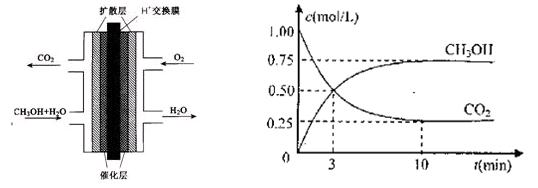
(3)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) ?CH3OH(g)+H2O(g)△H =-49.0KJ/mol
?CH3OH(g)+H2O(g)△H =-49.0KJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如上右图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=??????????????
②该反应的平衡常数表达式为?????????????????????????。
③下列措施中能使n(CH3OH)/n(CO2)增大的是????????????。
A.升高温度????????????????????????????????????????????????? B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离??????????????????????? D.再充入1molCO2和3molH2
5、填空题 (14分)
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2 2CO2+3H2O,制取二甲醚的反应如下:
2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO(g)+2H2(g) CH3OH(g) △H=-90.7kJ·mol-1
CH3OH(g) △H=-90.7kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式: 。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为 极,电极反应式为
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________________________________________
②生产中可用盐酸来除铁锈。现将 一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
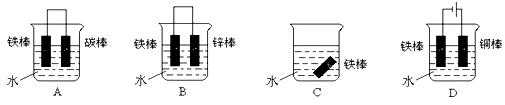
③下列哪个装置可防止铁棒被腐蚀_____________
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:
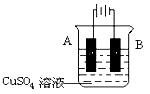
A电极对应的金属是 (写元素名称),
B电极的电极反应式是 ________________