微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 I、镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用???????,要使MgSO4完全转化为
沉淀,加入试剂的量应为?????????????。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是????????????。
(3)试剂②选用????????;写出其反应的离子方程式????????????????????????????。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为????????。
Ⅱ.关于《必修2》中提到的常见有机物,请回答下列问题:
(1)苯在常温常压下呈?????态。
(2)常温常压下气态直链烷烃含碳原子数≤?????????。
(3)苯和甲烷中含碳量较高的是?????????。
(4) 写出苯与浓硝酸、浓硫酸混合液加热反应的化学方程式(用结构简式书写)???????????????。
(5) 写出乙醇和乙酸的酯化反应方程式 ?????????????????。
2、选择题 2010年上海世博会主题“城市.让生活更美好”;2011年“国际化学年”的主题是“化学,我们的生活,我们的未来”;2013年1月全国大部分地区出现雾霾天气,北京PM2.5浓度达993,系中国有该监测数据以来最高的一次。“拯救人类的最后机会”只有节能减排,下列属最有希望的新能源是? ( )
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A.①②③④
B.⑤⑥⑦⑧
C.③④⑤⑥
D.除①②外
3、填空题 下图是工业上生产碳酸锂的部分工艺流程,请根据流程图及已知信息回答问题。
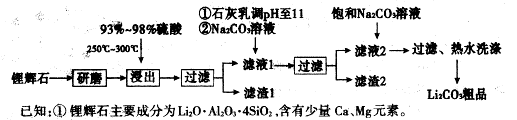
②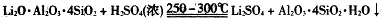
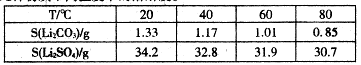
③几种物质不同温度下的溶解度。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。写出图中①、②、③表示的各物质,步骤II中反应的离子方程式是???????。
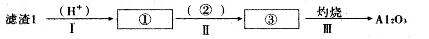
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:
??????????????????????。
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是????????。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是??????????。
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是????。
4、选择题 下列叙述正确的是?????????????????????????????????????????????????????????????????????????????
A.提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔
B.氯气是瑞典化学家舍勒发现的
C.海水中含有丰富的碘元素,因此碘被称为“海洋元素”
D.溴化银可用于人工降雨
5、填空题 硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为:
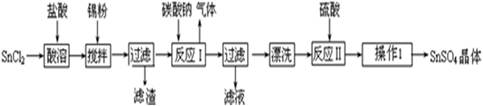
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第?????周期(1分)
(2)操作Ⅰ是 ???????????????过滤、洗涤等(2分)
(3)溶解SnCl2粉末需加浓盐酸,原因是??????????????????????????????????????????????????
(4)加入Sn粉的作用有两个:①调节溶液pH?②???????????????????????????????????
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是??????????????????????????????????????
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是??????????????????????????????????????????
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 +???K2Cr2O7 +???HCl = ?????FeCl3 + ?????KCl + ????CrCl2+????