?_________________?
?
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为??????????????????
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。

由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量
氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。
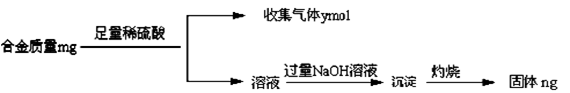
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n??????????? B.m、y?????????C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________
参考答案:(1)①不含锂(Li)、钠(Na)等活泼金属
②可能含
本题解析:
试题分析:(1)①原料加入冷水无现象表明不含Li、Na等活泼金属;
②原料与盐酸反应产生气体表明含有能与盐酸反应的较活泼的金属,例如铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种金属。
(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀,从而不能吸附镁试剂(I)染料呈天蓝色,所以不能检验不出Mg2+,要检验镁离子反应需要在解析条件下完成。
(3)合金能溶于盐酸,其溶液中滴加氨水生成白色沉淀。向白色沉淀中滴加过量的饱和氯化铵溶液,白色沉淀部分溶解,且剩余的白色沉淀既能和氢氧化钠溶液反应,也能和盐酸反应。因此根据Mg(OH)2可溶于浓的氯化铵溶液可知,该白色沉淀一定是由氢氧化镁和氢氧化铝组成的。由于Mg(OH)2可溶于浓的氯化铵溶液,因此用镁试剂(Ⅰ)染料检验Mg2+时要排除NH4+的干扰,所以滤液加入足量氢氧化钠溶液将NH4+转化为NH3,煮沸将氨气赶出,目的是防止NH4+干扰Mg2+的检验(或排除溶液中NH4+的干扰)。(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成。加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量,已知镁的质量和镁铝生成氢气的体积可知铝的质量,则A、B、C都可测定合金的组成,故答案为:A、B、C。
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,相对分子质量较小的为镁。若x=0,则全被为铝,7mol铝反应生成10.5mol氢气;如全被为镁,即x=7,则生成氢气7mol,所以图象为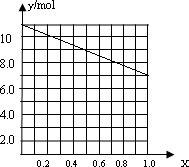 。 。
③设合金中镁和铝的物质的量分别是a和b,则a+b=7mol、a+1.5b=8.5mol,解得a=4mol、b=3mol,所以合金的组成是Mg4Al3。
本题难度:困难
2、实验题 FeSO4·7H2O广泛用于医药和工业领域。
(1)下面是以工业废铁屑为原料生产FeSO4·7H2O的流程图。
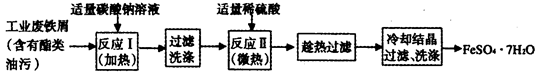
请填写下列空白。
①加适量碳酸钠溶液的目的是______________,反应I需要加热数分钟,其原因是___________。
②判断反应Ⅱ完成的现象是__________。反应Ⅱ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及____________.
③测定FeSO4·7H2O产品中Fe2+含量的方法是用KMnO4溶液滴定法(5Fe2++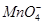 +8H+=5Fe3++Mn2++4H2O),步骤为: +8H+=5Fe3++Mn2++4H2O),步骤为:
Ⅰ.称取2.8500g FeSO4·7H2O产品,配制成250mL溶液;
Ⅱ.量取25.00mL待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.01000moL/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
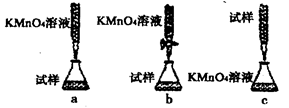
某同学设计如图所示的滴定方式中,最合理的是____________(夹持部分略去)(填字母序号);判断此滴定实验达到终点的方法是____________;计算上述样品中FeSO4·7H2O的质量分数为________(用小数表示,保留三位小数);若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________;______________。
(2)已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O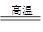 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。

请填写下列空白。
①仪器的连接顺序为a接________、__________接_________、________接__________、__________接_____________。
②装置C中的X为______________;该装置中冷水的作用是_________________。
参考答案:(15分)(1)①除油污(1分)?升温促进水解,溶液碱性增强
本题解析:
试题分析:(1)①由于工业废铁屑中含有酯类油污,所以必须除去酯类油污。碳酸钠溶液显碱性,可以溶解酯类油污达到去除的目的。由于升高温度促进水解,溶液碱性增强,去油污能力增强,所以反应I需要加热数分钟。
②反应Ⅱ是铁与稀硫酸的反应,生成物是硫酸亚铁和氢气,所以判断反应Ⅱ完成的现象是固体不再溶解,固体表面不再有气泡产生。配制一定物质的量浓度溶液时,所用的仪器除了有量筒、烧杯、玻璃棒、胶头滴管以外,还必须有100ml容量瓶。
③酸性高锰酸钾溶液应该放在酸式滴定管中,a中酸性高锰酸钾溶液放在碱式滴定管中,因此a不正确,b正确;硫酸亚铁溶液显酸性,应该放在酸式滴定管中,选项c不正确,答案选b。由于酸性高锰酸钾溶液显红色,所以该实验不需要指示剂。因此判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。根据方程式可知
5FeSO4·7H2O~KMnO4
5mol????????? 1mol
n???0.01000moL/L×0.0200L
解得n=0.0010mol
所以上述样品中FeSO4·7H2O的质量分数为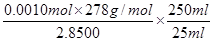 =0.975。 =0.975。
由于硫酸亚铁极易被氧化,所以若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低,因此可能的原因是样品部分被氧化或样品中存在少量的杂质。
(2)①检验水蒸气一般用无水硫酸铜,检验SO2一般用品红溶液。由于SO2的熔沸点较低,因此SO3气体易被水吸收生成硫酸,可以通过检验硫酸来检验SO3。又因为通过溶液时必然带出水蒸气,所以首先检验水蒸气,其次检验SO3,最后检验SO2,且还要有尾气吸收装置,因此正确的顺序是a、f、g、d、e、h、i、b(或a、g、f、d、e、h、i、b)。
②检验硫酸的试剂可以是氯化钡溶液。又因为SO3与H2O的反应是放热反应,所以装置中冷水的作用是降低温度,便于SO3被水吸收。
本题难度:一般
3、选择题 除去括号内杂质所用试剂和方法不正确的是(?)
A.Fe (Al)——氢氧化钠溶液,过滤
B.KNO3(NaCl)——结晶
C.水(NaCl)——蒸馏
D.淀粉(泥沙)——渗析
参考答案:C
本题解析:
试题分析:单质铝能溶于氢氧化钠溶液中,而铁不能,A正确;硝酸钾和氯化钠的溶解度受温度影响的程度不同,可以通过结晶法进行分离,B正确;要得到氯化钠晶体,应该通过蒸发结晶,C不正确;溶液能透过半透膜,而浊液不能,D正确,答案选C。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:
1. 不能引入新的杂质(水除外)。即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中。
2. 分离提纯后的物质状态不变。
3. 实验过程和操作方法简单易行。即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:
1. 分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解) ,溶解,过滤(洗涤沉淀) ,蒸发,结晶(重结晶) ,电精炼。
2. 分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏。
3. 分离提纯物是胶体:盐析或渗析。
4. 分离提纯物是气体:洗气。
本题难度:一般
4、选择题 下列实验能达到目的是( )
A.鉴别乙醇、乙醛、乙酸、甲酸可用新制氢氧化铜悬浊液分步进行
B.乙烷中混有少量乙烯,用氢气加成除去乙烯
C.苯中混有少量的苯酚,加入浓溴水沉淀后过滤除去苯酚
D.除去乙酸乙酯中混有的少量乙酸,加足量NaOH溶液加热充分反应后分液
参考答案:A.乙醇和氢氧化铜不反应,无明显现象,乙酸和甲酸都能使沉淀溶
本题解析:
本题难度:简单
5、选择题 为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行以下五项操作:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液。正确的操作顺序是(?)
A.③⑤②④①
B.④①②⑤③
C.②⑤④①③
D.①④②⑤③
参考答案:C
本题解析:除杂时为全部除去杂质,所加的试剂往往是过量的,所以就必须考虑如何除去过量的试剂。当有多种杂质时,还要考虑除杂的先后顺序。除钙离子用碳酸钠,除镁离子用氢氧化钠,除SO42-用氯化钡。过量的钡离子要用碳酸钠,钙离子的除杂必须在除SO42-的后面。最后通过盐酸来调节溶液的酸碱性,所以正确的答案是C。
本题难度:简单
|