微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:
(1)已知: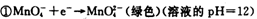
②
锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为?????(填化学式)。
(2)查阅相关资料:发生如下反应(反应未配平):
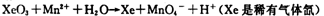
已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为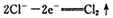
如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是?????。
(3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。
写出该反应的离子方程式??????????????。
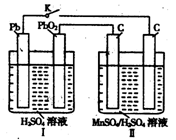
(4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为???????。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为???????,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为??????,MnO2的理论产量为?????g。
参考答案:(14分,每空2分)(1)MnO2?(2)无色溶液变为紫(或
本题解析:
试题分析:(1)根据反应①②可知,在碱性溶液中MnO4-被还原生成物是MnO42-,在酸性溶液中MnO4-被还原生成物是Mn2+,即溶液的酸性越强,还原产物中Mn的化合价越低,所以在中性溶液中,MnO4-被还原生成物是MnO2。
(2)根据已知反应可知,XeO3能把Mn2+氧化生成MnO4-。又因为氯离子的还原性强于Mn2+的还原性,所以反应中还有氯气生成,因此可能观察到的现象是无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体)。
(3)草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去,
本题难度:一般
2、填空题 (1)写出硫酸铁在水溶液中电离的电离方程式???????????????????????????
(2)用双线桥法,标出下列氧化还原反应的电子转移方向和电子总数
2FeCl3+Fe=3FeCl2??????????氧化剂是??????????(填化学式)
(3)氨的催化氧化是工业上制硝酸的基础:4NH3? + 5 O2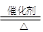 4NO + 6H2O ,其中作为还原剂的物质是?????????(填化学式);若反应中生成了0.2 mol NO,则转移???????mol电子,
4NO + 6H2O ,其中作为还原剂的物质是?????????(填化学式);若反应中生成了0.2 mol NO,则转移???????mol电子,
(4)在一定条件下,RO3n-和氯气可发生如下反应: RO3n- ?+ Cl2 + 2OH- = RO42- + 2Cl- ?+H2O由以上反应可知在上过程中RO3n-被????????(填“氧化”或“还原”), RO3n-中元素R的化合价是???????。
参考答案:17.(1)Fe2(SO4)3=2Fe3+ +2SO42-(
本题解析:
试题分析:(2)氯化铁中的铁从三价降低到二价,故得到了一个电子,发生还原反应,做氧化剂,即2个氯化铁就得到2个电子;铁中铁从零价升高到二价,故失去了2个电子,发生氧化反应,做还原剂。
(3)NH3中的N从-3价升高到+2价,发生氧化反应,做还原剂,O2中的O从0价降低到-2价,发生还原反应,做氧化剂。
4NH4-? 4NO-? 5e-
0.2mol??? x???? x=0.25mol
(4)由电荷守恒可知n=2,则RO32-中的R由+4价升高到+6价,发生了氧化反应。
本题难度:一般
3、选择题 铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某种盐后铜粉逐渐溶解,这种盐是(???? )
A.NaCl
B.KNO3
C.K2SO4
D.Na2CO3
参考答案:B
本题解析:
试题分析:由于在酸性条件下,硝酸盐具有氧化性,能和铜反应,所以正确的答案选B。
点评:该题是中等难度的试题,试题注重基础,侧重能力的训练和解题的灵活性。该题的关键是明确硝酸盐只有在酸性条件下,才具有氧化性,有助于培养学生的灵活应变能力。
本题难度:简单
4、填空题 (10分)氧化还原反应是重要的一类化学反应。
(1)在化学反应2KMnO4 + 10KI + 8H2SO4=6K2SO4+ 2MnSO4 + 5I2 + 8H2O中,化合价降低的元素是 ????????????,发生氧化反应的物质是??????????????。
(2)据反应8NH3 + 3Cl2=6NH4Cl + N2回答下列问题:
①该反应中,氧化剂是 ?????????????,还原剂是???????????。
②该反应中,当有8mol NH3反应时,转移电子总量是???????????mol。
③参加反应的氧化剂与还原剂的物质的量之比为 ?????????????????(最简整数比)。
④当有3mol e- 转移时,该反应生成的氧化产物的质量是???????????g。
参考答案:(共10分)(1)(2分) Mn(或锰);? KI(或碘化钾
本题解析:
试题分析:(1)根据反应的化学方程式可知,高锰酸钾中Mn元素的化合价从+7价降低到+2价,所以高锰酸钾是氧化剂;碘化钾中碘元素的化合价从-1价升高到0价,碘化钾是还原剂。
(2)①同样根据反应的化学方程式可知,氨气中氮元素的化合价从-3价升高到0价,失去3个电子,氨气是还原剂;氯气中氯元素的化合价从0价降低到-1价,得到1个电子,氯气是氧化剂。
②根据方程式可知,8mol氨气反应,被氧化的氨气是2mol,转移6mol电子。
③根据方程式可知,8mol氨气反应,被氧化的氨气是2mo
本题难度:一般
5、选择题 下列试剂中,不能使Fe3+变为Fe2+的是( )
A.SO2
B.A2S
C.Sn
D.氢溴酸
参考答案:D
本题解析:
【错解分析】该题为基础题,应相应复习有关铁三角的知识点,以便进一步清晰,掌握。
【正解】此题所考知识点为铁三角中Fe3+、Fe2+的转化。可将Fe3+转变为Fe2+的还原剂有Fe、Cu等金属H2S、HI、S2-、I-、SO2等,Fe3+遇SO2发生的离子反应方程式为:2Fe3++SO2+2H2O=2Fe2++4H++SO42-。所以A、B项都可将Fe3+转变为Fe2+,C项Sn按金属活动性顺序表,其还原性强于Cu,自然可被Fe3+氧化。
本题难度:简单