微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法正确的是
A.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大
2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0
参考答案:A
本题解析:
试题分析:A.CaSO4微溶于水,在溶液中存在沉淀溶解平衡,当加入饱和Na2CO3溶液浸泡时会发生沉淀反应形成CaCO3沉淀,促进CaSO4的溶解,沉淀转化为CaCO3,再加入盐酸CaCO3发生反应产生氯化钙、水和CO2,达到溶解沉淀的目的,正确;B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量CuSO4溶液或CuCl2溶液,但是由于在酸性环境中NO3-表现强氧化性,不能产生氢气,错误;C.N2(g)+3H2(g) 2NH3(g)的正反应是放热反应,在其他条件不变时,升高温度,根据平衡移动原理,平衡逆向移动,氢气转化率减小,错误;D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,ΔS<0,则该反应的ΔH<0,错误。
2NH3(g)的正反应是放热反应,在其他条件不变时,升高温度,根据平衡移动原理,平衡逆向移动,氢气转化率减小,错误;D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,ΔS<0,则该反应的ΔH<0,错误。
考点:考查沉淀的溶解与转化、影响化学反应速率、化学平衡的因素及反应自发进行的判据的知识。
本题难度:一般
2、选择题 对于可逆反应:2M(g)+N(g) 2P(g) ΔH<0,下列各图中正确的是( )
2P(g) ΔH<0,下列各图中正确的是( )
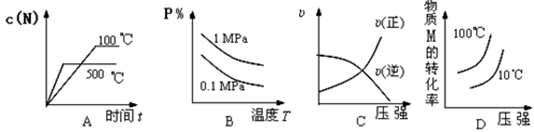
参考答案:B
本题解析:
试题分析:A、该反应是放热反应,所以温度升高,平衡逆向移动,N的浓度增大,所以平衡时温度高的曲线在温度低的曲线的上方,错误;B、温度升高,平衡逆向移动,P的含量减少,所以曲线向下,增大压强,平衡正向移动,P的含量增大,则压强大的曲线在压强小的曲线的上方,正确;C、增大压强,正逆反应的速率都增大,错误;D、增大压强,平衡正向移动,M的转化率增大,曲线向上,温度升高,平衡逆向移动,M的转化率降低,则温度高的曲线在温度低的曲线的下方,错误,答案选B。
考点:考查化学平衡的图像的分析,平衡移动的判断
本题难度:一般
3、填空题 2SO2+O2 2SO3的平衡体系中,加入由18O构成的氧气,当平衡发生移动后,SO2中18O含量______________(填“增加”“减少”或“不移动”),其原因是____________________。
2SO3的平衡体系中,加入由18O构成的氧气,当平衡发生移动后,SO2中18O含量______________(填“增加”“减少”或“不移动”),其原因是____________________。
参考答案:增加?在SO2与18O2反应生成S18O3的同时,S18O3
本题解析:正、逆反应总是同时发生,不断进行的。
本题难度:简单
4、选择题 下列有关推断中,不正确的是 [???? ]
事 实??
结 论???
A.
CaCO3+2CH3COOH=(CH3COO)2Ca +CO2↑+H2O
酸性: CH3COOH > H2CO3
B.
氢硫酸(H2S)放置在空气中变浑浊
氧化性:O2>S
C.
Al(OH)3既溶于强酸又溶于强碱
Al元素既有金属性也有非金属性
D.
反应A+2B C达平衡后,升高温度,平衡正向移动
C达平衡后,升高温度,平衡正向移动
升高温度,使v正增大、v逆减小
参考答案:D
本题解析:
本题难度:一般
5、选择题 在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生:
①IO3-+5I-+ 6H+==3I2+3H2O;
②I2+2HSO3-+H2O==2I-+2SO42-+4H+。
当反应进行到15min时,溶液突然变为蓝色,随之又很快消失。这一反应被称做时钟反应,有人用它来解释生物钟现象。下列有关说法不正确的是 [???? ]
A.在整个反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关
参考答案:C
本题解析:
本题难度:一般