微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度和压强下20mL?XY气体与10mL?Y2气体化合成10mL?Z气体,则Z的分子式为
A.X2Y4
B.XY2
C.X2Y6
D.X3Y
参考答案:A
本题解析:分析:同温同压下,气体的体积之比等于物质的量之比等于化学方程式的系数比,化学反应遵循原子守恒.
解答:20mLXY气体与10mLY2气体恰好完全反应生成10mLZ气体,所以气体的体积之比等于物质的量之比等于化学方程式的系数值比=2:1:1,即2XY+Y2=Z,根据化学反应前后原子总数相等,所以Z为X2Y4.
故选A.
点评:本题考查学生气体的体积之比等于物质的量之比等于化学方程式的系数比这一结论以及化学反应遵循原子守恒的思想,难度不大.
本题难度:困难
2、选择题 为证明铁的金属活动性比铜强,某同学设计了如下一些方案:
A.2种
B.3种
C.4种
D.5种
参考答案:A
本题解析:分析:①将铁片置于CuSO4溶液中,铁片上有亮红色物质析出,说明铁置换出了铜;
②氯气和金属反应时,氯气将金属氧化到最高价态;
③浓硫酸具有氧化性,可以将变价金属氧化到最高价;
④铜片置于FeCl3溶液中,会和三价铁发生反应生成亚铁离子和铜离子;
⑤在原电池中,负极金属的活泼性一般强于正极金属的活泼性.
解答:①铁置换出了铜,可以证明金属铁的活泼性强于金属铜,故①正确;
②氯气和金属反应时,氯气将金属铁和铜氧化到最高价态,不能证明金属的活泼性,故②错误;
③浓硫酸具有氧化性,可以将变价金属铁和铜氧化到最高价,不能证明金属的活泼性,故③错误;
④铜片置于FeCl3溶液中,会和三价铁发生反应生成亚铁离子和铜离子,只能证明还原性:Cu>Fe2+,
氧化性是:Fe3+>Cu2+,不能证明铁的金属活动性比铜强,故④错误;
⑤将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接,形成的原电池中,负极金属Fe的活泼性强于正极金属Cu的活泼性,能证明铁的金属活动性比铜强,故⑤正确.
故选A.
点评:本题考查学生金属活泼性的判断方法,可以根据所学知识来回答,注意平时知识的积累,综合性较强,难度中等.
本题难度:简单
3、选择题 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述错误的是
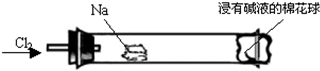
A.反应生成的大量白烟是氯化钠晶体
B.钠着火燃烧产生苍白色火焰
C.浸有NaOH溶液的棉球用于吸收未反应的氯气,以免污染空气
D.用干燥的淀粉碘化钾试纸可以检验氯气是否被完全吸收
参考答案:B
本题解析:分析:氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,火焰呈黄色,氯气易与NaOH溶液反应而被吸收,氯气具有强氧化性,与碘化钾发生置换反应.
解答:A.氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,反应时有大量白烟,故A正确;
B.钠着火燃烧产生黄色火焰,故B错误;
C.氯气有毒,不能排放到空气中,氯气易与NaOH溶液反应而被吸收,故C正确;
D.氯气具有强氧化性,与碘化钾发生置换反应,可根据其颜色变化判断氯气是否被碱液完全吸收,故D正确.
故选B.
点评:本题考查氯气的性质,题目难度不大,注意相关基础知识的积累.
本题难度:简单
4、选择题 在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(NO3-)为
A.0.15mol/L
B.0.20mol/L
C.0.25mol/L
D.0.40mol/L
参考答案:D
本题解析:分析:根据溶液不显电性,则阳离子的电荷总数等于阴离子的电荷总数,以此来解答.
解答:KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,
设c(NO3-)为x,由电荷守恒可知,
0.1mol/L×1+0.25mol/L×2=0.2mol/L×1+x×1,
解得x=0.40mol/L,
故选D.
点评:本题考查离子浓度的计算,明确电荷守恒是解答本题的关键,题目难度不大.
本题难度:困难
5、选择题 在4℃时向100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液.下列说法中不正确的是
A.该溶液物质的量浓度为10mol?L-1
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数约为26.7%
D.所得溶液的体积为22.5L
参考答案:AD
本题解析:分析:A、标准状况下22.4LHCl的物质的量为1mol,根据题目信息无法计算溶液的体积;
B、因溶液的密度未知,无法计算溶液的体积;
C、溶液质量=溶质质量+溶剂质量,溶质质量分数=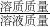 ×100%,据此计算;
×100%,据此计算;
D、溶液体积不等于溶剂与溶质的体积之和,利用V= 计算溶液体积.
计算溶液体积.
解答:A、标准状况下22.4LHCl的物质的量为1mol,溶于水配成100mL溶液,溶液的浓度为10mol/L,而水的体积为100mL,因溶液的密度未知,无法计算溶液的体积,无法计算该溶液的物质的量浓度,故A错误;
B、因溶液的密度未知,无法计算溶液的体积,无计算该溶液的物质的量浓度,故B正确;
C、标准状况下22.4LHCl的物质的量为1mol,质量为36.5g,4℃时100mL水的质量为100g,所以溶液溶质的质量分数为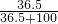 ×100%=26.74%,故C正确;
×100%=26.74%,故C正确;
D、溶液体积不等于溶剂与溶质的体积之和,因溶液的密度未知,无法计算溶液的体积,故D错误.
故选AD.
点评:本题考查对物质的量浓度理解、质量分数计算等,难度不大,注意物质的量浓度及与质量分数的关系.
本题难度:简单