微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=" —574" kJ·mol- 1.
CH4(g) + 4NO(g) = 2N2(g)+ CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
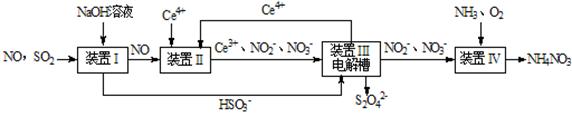
(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
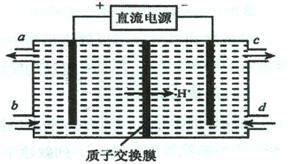
①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
2、计算题 有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属恰好全部析出,经称量阴极增重0.32g。求:
(1)金属M的相对原子质量及x、y。
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)。
3、选择题 用惰性电极电解下列溶液,起始时在阳极上不能生成O2的是(???)
A.KNO3
B.Na2S
C.Ba(OH)2
D.H2SO4
4、选择题 下列关于铜电极的叙述,正确的是 [???? ]
A.铜锌原电池中铜为负极,发生氧化反应
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用精铜作阳极
D.电解稀H2SO4制H2、O2时,可用铜作阳极
5、选择题 某同学为了使反应2HCl+2Ag===2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是( )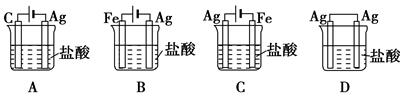
[-p来源:91 考试网age-]
1、填空题 (14分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=" —574" kJ·mol- 1.
CH4(g) + 4NO(g) = 2N2(g)+ CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
参考答案:(1)CH4(g)+2NO2(g)=2H2O(g)+ CO2
本题解析:
试题分析:(1)根据盖斯定律,将两个已知热化学方程式相加得2CH4(g)+4NO2(g)=4H2O(g)+2 CO2(g)+2N2(g) △H=(—574 kJ·mol- 1)+(一1160 kJ·mol- 1)=-1734kJ/mol,所以甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=2H2O(g)+ CO2(g)+N2(g) △H=-867kJ/mol
(2)由图可知,NO被Ce 4+ 氧化为NO3- ,则Ce4+被还原为Ce3+,所以只生成NO3- 的离子方程式为NO+2H2O+3Ce4+=3Ce3++NO3-+4H+
(3)①装置Ⅲ的作用之一是再生Ce4+,在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上a极流出,
②电解池的阴极发生得电子的还原反应,亚硫酸氢根离子得电子生成S2O42-,电极反应式为2H++2HSO3-+2e-=S2O42-+2H2O
(4)NO2-的浓度为a g?L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子的物质的量是(1000×ag)/46g/mol×(5-3),设需要标准状况下的O2VL,则氧气得电子的物质的量是VL/22.4L/mol×2×(2-0),根据氧化还原反应中得失电子守恒定律,有(1000×ag)/46g/mol×(5-3)= VL/22.4L/mol×2×(2-0),解得V=243aL。
考点:考查盖斯定律的应用,离子方程式的书写,电化学反应原理的应用,氧化还原反应的计算
本题难度:一般
2、计算题 有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属恰好全部析出,经称量阴极增重0.32g。求:
(1)金属M的相对原子质量及x、y。
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)。
参考答案:(1)n(M)=n[M(NO3)x·yH2O]=![]()
本题解析:
试题分析:由题知用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g,故A极为阴极;析出的金属电极反应为:
Mx+??+? xe-???═? M
1?????????x????????????M
0.005mol??0.01mol??? 0.32g??
计算得到M=64g/mol;
x=2;
M(NO3)x?yH2O经测定其摩尔质量为242g?mol-1.
64+62×2+18y=242
y=3
本题难度:一般
3、选择题 用惰性电极电解下列溶液,起始时在阳极上不能生成O2的是(???)
A.KNO3
B.Na2S
C.Ba(OH)2
D.H2SO4
参考答案:B
本题解析:
试题分析:用惰性电极电解溶液时,在阳极上不能生成O2的阴离子放电在OH-之前,放电顺序S2->I->Br->Cl->OH->含氧酸根。故选B
本题难度:简单
4、选择题 下列关于铜电极的叙述,正确的是 [???? ]
A.铜锌原电池中铜为负极,发生氧化反应
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用精铜作阳极
D.电解稀H2SO4制H2、O2时,可用铜作阳极
参考答案:C
本题解析:
本题难度:一般
5、选择题 某同学为了使反应2HCl+2Ag===2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是( )
参考答案:C
本题解析:考查电解池的应用。银剩余不活泼的金属,和盐酸不能发生置换反应生成氢气。要是反应能够进行,则必须借助于电解,此时银和电源的正极相连,作阳极,所以选项C是正确的。答案选C。
本题难度:一般