微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是???????????;
(2)指出实验步骤中存在的错误并改正:??????????????????????????????????????;
(3)硫酸钠不能放置在空气中冷却的原因是????????????????????????????????????;
(4)步骤⑤的目的是??????????????????????????????????;
(5)下面的情况有可能造成测试结果偏高的是????(填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出
参考答案:(1)坩埚钳、酒精灯(可以不答“火柴”)
(2)步骤②
本题解析:
【错解分析】注意实验用品的选择,不多不漏,明确实验目的,实验步骤和实验现象。
【正解】对实验的基本操作不熟悉,致使第(1)题选错实验仪器,如漏填坩埚钳等。对所含结晶水的质量分数的计算式理解不透彻或不会分析,而使第(5)题多选C等。
【正确解答】本题是一个定量实验,实验的目的是测定硫酸钠晶体中结晶水的质量分数。
(1)根据实验步骤结合已经给知的实验仪器,可以得出使用坩埚时必须使用坩埚钳进行挟持。因实验需要加热坩埚,因此需要使用酒精灯、泥三角等仪器。
(2)将各步实验进行观察和分析,会发现步骤②中的称量存在问题:若先称量样品再在研钵种研细,必然会导致部分样品附着在研钵上而损失部分样品。正确的操作应为先用研钵将样品研细,再进行称量。
(3)硫酸钠晶体加热失去结晶水后生成的无水硫酸钠,若在空气中冷却又会重新吸生成硫酸钠晶体,因此应将失水后的硫酸钠放于干燥器中进行冷却。
(4)实验步骤⑤的目的是保证试样脱水完全。
(5)假设步骤①中坩埚的质量为m1,步骤②中坩埚和样品的质量为m2,步骤⑤中称量的质量为m3。则硫酸钠晶体中结晶水的质量分数为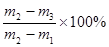 ,A选项试样中含有加热不挥发的杂质,将会使m3偏大,结果偏小;B选项中试样中含有加热易挥发的杂质,将会使m3偏小,结果偏大;C选项中测试前试样已有部分脱水,将会使m2-m3的值偏小,结果偏小;D选项中实验前坩埚未完全干燥将会使m1偏大,结果偏大;E选项中晶体加热脱水不完全,将会使m3偏大,结果偏小;F选项中加热时有晶体溅出,将会使m3偏小,结果偏大。
,A选项试样中含有加热不挥发的杂质,将会使m3偏大,结果偏小;B选项中试样中含有加热易挥发的杂质,将会使m3偏小,结果偏大;C选项中测试前试样已有部分脱水,将会使m2-m3的值偏小,结果偏小;D选项中实验前坩埚未完全干燥将会使m1偏大,结果偏大;E选项中晶体加热脱水不完全,将会使m3偏大,结果偏小;F选项中加热时有晶体溅出,将会使m3偏小,结果偏大。
本题难度:一般
2、选择题 在实验室中,下列除杂的方法正确的是( ?)
A.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴
B.乙烷中混有乙烯,通H2在一定条件下反应,使乙烯转化为乙烷
C.硝基苯中混有浓H2SO4和浓HNO3,将其倒入NaOH溶液中,静置,分液
D.乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶
参考答案:CD
本题解析:溴能把碘化钾氧化生成单质碘,碘易溶再有机溶剂中,且汽油和溴苯是易溶的,A不正确,应该用氢氧化钠溶液。B不正确,这样容易引入杂质氢气,应该是通过溴水。所以正确的答案选CD。
本题难度:简单
3、选择题 下列获取物质的方法,不正确的是( )
A.用电石和饱和食盐水制取乙炔
B.通过石油分馏得到甲烷、乙烯和苯
C.用碳酸钠和氢氧化钙反应制氢氧化钠
D.将氯气通入氢氧化钠溶液得到漂白液
参考答案:B
本题解析:
答案:B
B、不正确,通过石油裂解得到甲烷、乙烯,通过催化重整得到苯
本题难度:一般
4、选择题 下列可用浓H2SO4干燥的气体有( )
①H2??②SO2??③H2S???④Cl2???⑤NH3???⑥HCl???⑦CO2???⑧HBr???⑨CO.
A.①②③④⑥⑧⑨
B.①②④⑥⑦⑨
C.①②④⑤⑥⑦⑧
D.全部
参考答案:浓硫酸具有酸性、吸水性、脱水性、强氧化性,所以不能干燥具有碱
本题解析:
本题难度:简单
5、实验题 (13分)氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是????????。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
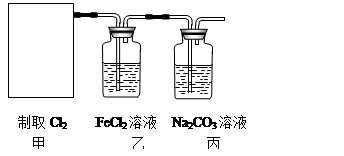
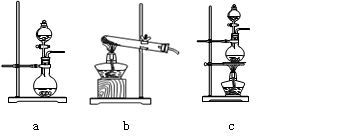
①在该实验中,甲部分的装置是???????????????(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是???????????????。证明FeCl2与Cl2发生了氧化还原反应的实验方法是???????????????????????????。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是??????????????。
④该实验存在明显的缺陷,改进的方法是??????????????????????????。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为????。
参考答案:(1)MnO2 + 4HCl(浓) 本题解析:(1)方程式为MnO2 + 4HCl(浓)
本题解析:(1)方程式为MnO2 + 4HCl(浓)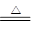 ?MnCl2 + Cl2↑+ 2H2O。
?MnCl2 + Cl2↑+ 2H2O。
(2)①根据反应原理可知,反应需要加热,硫酸是溶液,所以应该选择c装置。
②氯气具有氧化性,能把氯化亚铁氧化生成氯化铁,方程式为2Fe2++Cl2 ="==" 2Fe3++2Cl-。由于生成物是氯化铁,所以要证明FeCl2与Cl2发生了氧化还原反应,可以通过检验铁离子来证明。即取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+ ,即FeCl2与Cl2发生了氧化还原反应。
③由于碳酸的酸性强于次氯酸,所以反应中不可能生成CO2,因此方程式为Cl2+2Na2CO3+H2O ="==" NaCl+NaClO+2NaHCO3。
④由于氯气有毒,属于大气污染物,需要尾气处理,即应该在在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶。
(3)次氯酸钙和碘化钾反应的方程式为ClO-+2I-+2H+=I2+Cl-+H2O,所以次氯酸钙和Na2S2O3的关系式为Ca(ClO)2~4Na2S2O3。所以25ml溶液中含有次氯酸钙的物质的量是0.1 mol/L×0.02L÷4=0.0005mol,质量是0.0005mol×143g/mol=0.0715g,所以质量分数是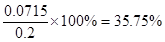 。
。
本题难度:一般