微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究小组在实验室中用铜粉(含铁粉5%以上)制取胆矾(CuSO4·5H2O)并检验其纯度,限选试剂:3 mol·L-1H2SO4溶液、浓硝酸、3%H2O2溶液、0.2 mol·L-1NaOH溶液、20% KSCN溶液、BaCl2溶液。有关物质溶解度如下表(单位g/100 g H2O):
温度/℃
| 0
| 20
| 40
| 60
| 80
| 100
|
CuSO4
| 14.3
| 20.7
| 28.5
| 40.0
| 55.0
| 75.4
|
Cu(NO3)2
| 81.8
| 124.8
| 163.1
| 181.8
| 207.8
| 247.3
?
(1)完成制取胆矾的实验方案。
实验步骤
| 预期现象
| 步骤1:除铁。将铜粉置于烧杯中,__________________
| _______________________
| 步骤2:溶解。将步骤1得到的铜粉置于烧杯中,
__________________________
| _______________________
| 步骤3:结晶。将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品
| ?
?
(2)完成步骤1后,检验铜粉中的铁是否除尽的实验操作是___________。
(3)若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2。样品中CuSO4·5H2O的质量分数为________(列出算式)。
参考答案:(1)
实验步骤
预期现象
步骤1:加入足
本题解析:(1)制备胆矾的实验设计:根据所给试剂,由于铜不能直接与稀硫酸反应,因此需要氧化剂(H2O2或HNO3)将铜氧化为Cu2+,Cu2+对H2O2的分解有催化作用,因此只能用浓硝酸氧化,但如果直接用浓硝酸氧化生成Cu(NO3)2,再和硫酸通过复分解反应制备CuSO4,会增大HNO3的用量且会引入Cu(NO3)2杂质。因此实验中借助反应:3Cu+8H++2NO===3Cu2++2NO↑+4H2O,即先加硫酸,再加浓硝酸。(2)检验铜中的铁粉是否除尽,还可以通过检验最后一次硫酸洗涤液中是否含有Fe2+来确定。
(3)CuSO4·5H2O ~ BaSO4
250 ?? ? 233
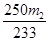 ????? m2 ????? m2
则样品中CuSO4·5H2O的质量分数为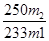 ×100%。 ×100%。
本题难度:一般
2、实验题 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下?
 ? ?
根据要求填空:?
(1) B装置有三种功能:①_________________;②____________;③
________________________。?
(2) 设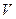 ?(Cl2)/ ?(Cl2)/ 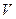 ?(CH4) = ?(CH4) = ,若理论上欲获得最多的氯化氢,则 ,若理论上欲获得最多的氯化氢,则 值的取值范围为___________。? 值的取值范围为___________。?
(3) D装置的石棉中均匀混有KI粉末,其作用是___________________。?
(4)E装置的作用是_______________(填编号)。?
A.收集气体???????????????? B.吸收氯气?
C.防止倒吸???????????????? D.吸收氯化氢?
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。?
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。?
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。?
A.CH4???????????????????????????????B.CH3Cl?
C.CH2Cl2???????????????????????????D.CHCl3?
E.CCl4?
参考答案:(1)①控制气流速度 ②均匀混合气体 ③干燥混合气体?
本题解析:A装置为制取氯气的发生装置,B装置可以除去水蒸气,可以混合甲烷和氯气,同时还可以通过产生气泡的快慢调节气体的流速;由于上述过程中产生的氯气和HCl均易导致大气污染,所以E的作用是吸收尾气;根据甲烷与氯气的反应可知欲获得较多的HCl,也就是使甲烷中的氢原子全部转化为HCl,此时消耗的氯气的物质的量至少是甲烷物质的量的4倍。?
本题难度:简单
3、选择题 含CO、N2、H2、CO2和水蒸气的混合气体,依次通过NaOH溶液、灼热的CuO和浓硫酸,设反应完全,最后剩余的气体是( )
A.N2和CO2
B.N2和H2
C.N2和CO
D.无任何气体
参考答案:氢氧化钠会吸收混合气中的CO2,浓硫酸会吸收水蒸气,一氧化碳
本题解析:
本题难度:简单
4、填空题 用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
⑴所需浓H2SO4的体积为 ?????????????????
⑵如果实验室有10mL、20mL、50mL量筒,应选用 ??????????mL量筒,实验中还需要用到的仪器有???????????????????????????????????????????????????
⑶若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容????????????????????
②定容时俯视刻度线???????????????????
⑷若定容时液面高于刻度线应采取的措施是????????????????
参考答案:⑴? 13.6ml??⑵ ?20
本题解析:略
本题难度:简单
5、填空题 (10分)(1)在质量分数为28%的KOH水溶液中,OH-离子与H2O分子数之比是_______。
(2)在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2∶1,则该混合物中含CaCl2的质量分数为__________,KCl与CaCl2的物质的量之比为__________,含1 mol Cl-的该混合物的质量是____________g。
(3)在标准状况下,由CO和CO2组成的混合气体13.44 L,质量为20 g,该混合气体中,碳与氧两种原子的数目之比为__________。
参考答案:(1)5∶4
(2)42.7%? 2∶1? 86.7<
本题解析:(1)分别求出KOH和H2O的质量,转换成物质的量。
(2)混合物的物质的量比n(KCl)∶n(CaCl2)=2∶1再细分项计算。
(3)设CO、CO2分别为x mol,y mol
(x+y)×22.4="13.44?????????????????????????????????????????????????????????????" ①
(28x+44y)="20???????????????????????????????" ??????????????????????????????????②
再求(x+y)/(x+2y)=3∶4。
本题难度:简单
|
|