微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3

请回答下列问题:
(1)在一恒容密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内, (H2)=?????????????;10min时,改变的外界条件可能是??????????????.
(H2)=?????????????;10min时,改变的外界条件可能是??????????????.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象
(3)反应③中△H3=?????????.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO
| H2O
| CO2
| H2
|
0.5mol
| 8.5mol
| 2.0mol
| 2.0mol
?
此时反应③中正、逆反应速率的关系式是??????(填代号).
a.v(正)>v(逆)????? b.v(正)<v(逆)
c.v(正)=v(逆)?????? d.无法判断.
参考答案:(1) 0.3mol/(L?min)???升高温度
(
本题解析:
试题分析:(1)由图1可知,前5min内甲烷的浓度变化为0.50 mol·L-1,根据v=△c/△t计算v(CH4)= 0.1mol/(L?min)结合反应速率之比等于化学计量数之比计算可得v(H2)= 0.3mol/(L?min),注意写清单位;由图1可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,而该反应为吸热反应,则改变的条件可能为升高温度。(2)由图1结合题意知甲容器的反应条件为等温等容,乙容器的反应条件为等温等压,甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两
本题难度:一般
2、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
 
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9
B.16
C.20
D.25
参考答案:C
本题解析: ???? ????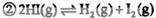
C0????????????????????????????????????????5?????
本题难度:一般
3、填空题 在体积固定的密闭容器中,进行如下化学反应:N2O4(g) 2NO2(g),其化学平衡常数K和温度t的关系如下表: 2NO2(g),其化学平衡常数K和温度t的关系如下表:
t /℃
| 80
| 100
| 120
| K
| 1.80
| 2.76
| 3.45
?
请回答下列问题:
(1)该反应的化学平衡常数表达式K=???????????????????????。
(2)该反应为???????????反应(填“吸热”或“放热”)。
(3)判断该反应达到化学平衡状态的依据是???????????????。
A.容器内混合气体密度不变
B.混合气体中c(NO2)不变
C.0.5mol N2O?4分解的同时有1 mol NO2生成
(4)在80℃时,将2.80molN2O4气体充入2L固定容积的密闭容器中,一段时间后对该容器内的物质进行分析,得到如下数据:
 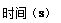
| 0
| 20
| 40
| 60
| 80
| 100
| n(N2O4)
| 2.80
| A
| 2.00
| c
| d
| 1.60
| n(NO2)
| 0
| 0.96
| b
| 2.08
| 2.40
| 2.40
?
①b的值为???????????;
②N2O4的平衡转化率为???????????????;
③20s~40s内用N2O4表示的平均反应速率υ(N2O4)=????????????。
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K=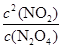 。 。
(2)根据表中数据可知,随着温度的升高,平衡常数逐渐增大。这说明升高温度平衡向正反应方向移动,因此正方应是吸热反应。
本题难度:一般
4、填空题 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g)??△H=一92. 4 KJ·mol-1 2NH3(g)??△H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有 N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
A.①③④
B.①②④⑤
C.①④⑤
D.②③④
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
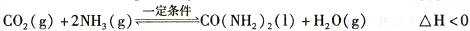
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
时间/min
| 0
| 30
| 70
| 80
| 100
| n(CO2) /mol
| 0.10
| 0.060
| 0.040
| 0.040
| 0.040
?
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_????(填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_??????(保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是?????????(填图甲中的“A”或“B”)。
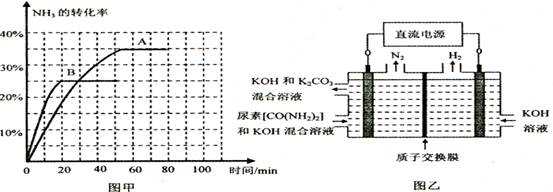
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为????????????????,若两极共收集到气体22. 4L(标
况),则消耗的尿素为????????????g(忽略气体的溶解)。
参考答案:21.(1)C; (2)①>;②增大;③76.53④B
本题解析:
试题分析: (1)?①单位时间内生成3n mol H2:同时生成2n mol NH3,相当于同一物质的正逆反应速率相等,正确;②用NH3、N2、H2表示反应速率比为? 2∶1∶3 ,无论是平衡还是没有平衡这个关系均成立,错误;③混合气体的密度不再改变,由于在整个恒容容器中,气体质量不变,所以密度一直不变,不能做为平衡判断依据,错误; ④气体总物质的量反应前后发生改变,混合气体压强不再改变时可以做为判断依据,正确; ⑤混合气体平均相对分子质量等于总质量除以总物质的量,质量不变但总物质的量发生改变,当
本题难度:困难
5、选择题 在恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生反应:A(g)+2B(g)  2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( ) 2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为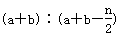
C.当2v正(A)=v逆(B) 时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
参考答案:C
本题解析:
试题分析:根据化学方程式,A、B转化的物质的量分别为0.5n mol、n mol,故A、B的转化率之比为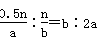 ,A错误;由于该反应在恒温、恒压下进行,因此起始时和平衡时容器中的压强之比为1∶1,B错误;当2v正(A)=v逆(B)时,正逆反应速率相等,反应达到平衡状态,C正确;充入惰性气体(如Ar),由于保持恒 ,A错误;由于该反应在恒温、恒压下进行,因此起始时和平衡时容器中的压强之比为1∶1,B错误;当2v正(A)=v逆(B)时,正逆反应速率相等,反应达到平衡状态,C正确;充入惰性气体(如Ar),由于保持恒
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|