56
(1)根据以上热值数据,最理想的燃料是______.
(2)根据以上热值数据,写出在该状态下表达氢气燃烧热的热化学方程式______.
(3)若管道煤气(含体积比为1:1的H2和CO)价格为1.00元/m3,天然气的价格为2.50元/m3,使用哪种气体在经济上更为合算?______??理由是______.(无需写出计算过程)
参考答案:(1)由表中数据可看出H2的热值最大,且H2为绿色能源,无污
本题解析:
本题难度:一般
2、填空题 (15分)能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g) △H=akJ·mol-1
CO(g)+1/2O2(g)= CO2(g) △H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=ckJ·mol-1
则反应:4Fe(s)+3O2(g)= 2Fe2O3(s)的焓变△H= kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)= 2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极: ,
正极: 。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:
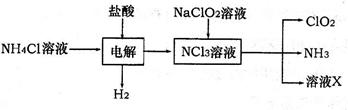
已知:电解过程中发生的反应为:
NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价。 NCl3+3H2↑;假设NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式 。
②在阳极上放电的物质(或离子)是 。
③除去ClO2中的NH3可选用的试剂是 (填序号)
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗 mol NCl3。
参考答案:Ⅰ、6(c-b)-2a(2分);
Ⅱ、(1)D(2分)
本题解析:
试题分析:Ⅰ、①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJ?mol-1
②CO(g)+1/2O2(g)=CO2(g)△H=bkJ?mol-1
③C(石墨)+O2(g)=CO2(g)△H=ckJ?mol-1
依据盖斯定律(③-②)×6-①×2得到4Fe(s)+3O2(g)=2Fe2O3(s)△H=6(c-b)-2a kJ?mol-1
Ⅱ、(1)设计成原电池需要是自发进行的氧化还原反应;
A.C(s)+CO2(g)=2CO(g)是非自发进行的氧化还原反应,故A不选;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l),反应是复分解反应,不是氧化还原反应,故B不选;
C.2H2O(l)=2H2(g)+O2(g),反应是非自发进行的氧化还原反应,故C不选;
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l),是自发进行的氧化还原反应,可以设计成原电池;故D选;
D反应是甲烷燃料电池,在碱溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应;
负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O;
正极电极反应为:O2+2H2O+4e-=4OH-;
(2)NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价. NCl3+3H2↑;假设NCl3中氮元素为+3价.
①电解时阴极上是氢离子得到电子生成氢气,阴极的电极反应式为:2H++2e-=H2↑;
②电解时阳极上是铵根离子失去电子生成氢气,故答案为:NH4Cl(NH4+);
③A、ClO2易溶于水,不能利用碳酸钠溶液吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;
D、ClO2易溶于水,不能利用水吸收氨气,故D错误;
故选:C;
④NCl3与NaClO2恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl3+3H2O+6ClO2-=6ClO2↑+3Cl-+3OH-+NH3↑,生产过程中,每生成1mol ClO2,需消耗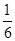 mol,故答案为: mol,故答案为: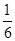 mol。 mol。
考点:考查了热化学方程式和盖斯定律的计算应用,原电池、电解池原理的分析判断,和电极反应书写方法,氧化还原反应计算的分析判断。
本题难度:困难
3、选择题 下列燃烧反应的反应热不是燃烧热的是
①H2(g)+O2(g)=H2O(l) ΔH1 ②C(s)+O2(g)=CO(g) ΔH2
③S(s)+O2(g)=SO2(g) ΔH3 ④2H2S(g)+3O2(g)=2SO2(s)+2H2O(l) ΔH4
A.①③
B.②④
C.②③
D.①④
参考答案:B
本题解析:
试题分析:①生成水是最稳定状态液态水,故①正确;②应生成CO2,不是燃烧热,故②错误;③符合燃烧热的定义,故③正确;④可燃物的系数不是1,故④错误.
考点:燃烧热
本题难度:一般
4、选择题 2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷,悉尼奥运会火炬所用燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为:2221.5KJ/mol,下列有关说法正确的是( ? ) A.丙烷的沸点比正丁烷高
B.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
C.奥运火炬燃烧主要是将化学能转变为热能和光能
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol
参考答案:C
本题解析:
本题难度:简单
5、填空题 (10分)试回答下列各问题:
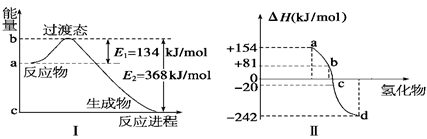
(1)如图Ⅰ所示是1 mol NO2和CO反应生成 CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g) ="==" 2HCl(g) ΔH="-185" kJ/mol;
键能ΔH298(H—H)="436" kJ/mol,ΔH298(Cl—Cl)="247" kJ/mol,则ΔH298(H—Cl)= 。
②图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲生成氢化物时的焓变数据,根据这组焓变数据可确定a、b、c、d分别代表的元素,试写出硒化氢发生分解反应的热化学方程式: 。
(3)已知: ①Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH="-a" kJ/mol 2Fe(s)+3CO2(g) ΔH="-a" kJ/mol
②3Fe2O3(s)+CO(g)  2Fe3O4(s)+CO2(g) ΔH="-b" kJ/mol 2Fe3O4(s)+CO2(g) ΔH="-b" kJ/mol
③Fe3O4(s)+CO(g)  3FeO(s)+CO2(g) ΔH="+ckJ/mol" 3FeO(s)+CO2(g) ΔH="+ckJ/mol"
则FeO(s) +CO(g)  Fe(s)+CO2(g) ΔH=- 。 Fe(s)+CO2(g) ΔH=- 。
参考答案:(1)NO2(g)+CO(g) ="==" NO(g)+CO
本题解析:(1)根据图Ⅰ可知反应物的总能量高于生成物的总能量,是放热反应,放出的热量是368kJ/-134 kJ=234 kJ,所以热化学方程式为NO2(g)+CO(g) ="==" NO(g)+CO2(g) ΔH="-234" kJ/mol。
(2)②反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此ΔH="=436" kJ/mol+247 kJ/mo-2X=-185 kJ/mo,解得X=434 kJ/mol。
①非金属性越强,和氢气化合越剧烈,放出的热量就越多。所以a、b、c、d分别代表的元素是碲、硒(Se) 、硫、氧。生成硒化氢的反应是吸热反应,则逆反应就是放热反应,所以硒化氢发生分解反应的热化学方程H2Se(g) ="==" Se(s)+H2(g) ΔH="-81" kJ/mol。
(3)根据盖斯定律可知,①×3-②-③×2即得到6FeO(s) +6CO(g)  6Fe(s)+6CO2(g),所以反应热为ΔH= -(3a-b+2c)kJ/mol。 6Fe(s)+6CO2(g),所以反应热为ΔH= -(3a-b+2c)kJ/mol。
本题难度:一般
|