微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.10 mL 0.1 mol·L-1NH4C1溶液与5 mL、0.2 mol·L-1NaOH溶液混合: c(Na+)=c(C1-)>c(OH-)>c(NH4+)>c(H+)
B.0.1 mol.L-1 pH=4的NaHB的溶液中,c(Na+)>c(HB-)c(H2B)>c(B2-)
C.常温时,NaHCO3溶液中:c(Na+)= c(HCO3-) +c(H2CO3)
D.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸中由水电离出的c(H+):①>②>③
参考答案:A
本题解析:A 对混合之后得到0.01molNaCI溶液和0.01molNH3.H2O溶液,离子浓度为c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+)
B 错0.1 mol.L-1 pH=4的NaHB的溶液中,c(Na+) >c(HB- ) c(H2B)<c(B2-)
C 错常温时,NaHC03溶液中:c(Na+)= c(HCO3-) +c(H2CO3)+c((CO32-)
D 错相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸中由水电离出的c(H+):①>②=③
本题难度:困难
2、填空题 (6分)水是生命之源,也是化学反应的主角。试回答下列问题:
A、B、C是中学化学常见的三种有色物质(其组成元素均属于短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
(1)A +H2O:__________________;(2)B+H2O:_________________;(3)C +H2O:___________ ___。
参考答案:(6分)(1)3NO2+ H2O == 2HNO3+ NO(
本题解析:
试题分析:能够与水发生反应,而且水既不是氧化剂也不是还原剂,相对分子质量逐渐增大的有色物质有NO2、Cl2、Na2O2。它们发生反应的方程式是(1)3NO2+ H2O == 2HNO3+ NO;(2)Cl2+H2O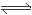 HCl+HClO;(3)2Na2O2+2H2O="=4NaOH+" O2↑。
HCl+HClO;(3)2Na2O2+2H2O="=4NaOH+" O2↑。
考点:考查物质的性质及应用的知识。
本题难度:一般
3、选择题 在下列反应中,硫酸只表现出强氧化性的反应是( )
A.C与浓H2SO4反应
B.Cu与浓H2SO4反应
C.CuO与H2SO4反应
D.Mg(OH)2与H2SO4反应
参考答案:A
本题解析:物质所含元素化合价升高的,即得到电子的物质是氧化剂,氧化剂具有氧化性,A中S的化合价全部降低,浓硫酸只体现氧化性。B中还生成硫酸铜,既体现氧化性,还体现酸性。CD中都不是氧化还原反应,只体现酸性,答案选A。
本题难度:一般
4、选择题 设C+CO2=2CO △H>0的反应速率为V1;N2+3H2=2NH3△H<0的反应速率为V2。若升温,V1和V2的变化可能是:
A.同时增大
B.同时减少
C.V1增大、V2减少
D.V1减少、V2增大
参考答案:A
本题解析:考点:化学反应速率的影响因素.
分析:升高温度,无论对于吸热还是放热反应,都会使反应速率增大.
解:升高温度时,活化分子的百分数增大,正逆反应速率都增大,吸热反应或放热反应的速率都增大,与吸放热无关.
故选A.
本题难度:一般
5、选择题 NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋
白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力。
(1)美蓝是亚硝酸盐中毒的有效解毒剂,下列说法正确的是 。(选填编号)
A.解毒时美蓝表现氧化性
B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原
D.中毒过程中血红蛋白显氧化性
(2)NaNO2中钠离子核外有 种不同能级的电子,三种元素对应的简单离子半径由大到小的顺序为 。
(3)Na、N、O分别与H形成的简单化合物中熔点最高的是 (填化合物化学式),试解释原因 。
(4)已知NaNO2能发生如下反应(未配平):NaNO2 + HI → NO + I2 + NaI + H2O当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)有人将26中反应产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107 Pa,然后加热至50℃时,发现气体的压力迅速下降。当温度恢复到常温,压强降至略小于1.01×107 Pa的2/3时,就不再改变。已知此过程中有一种产物是N2O。请写出生成N2O的反应方程式: 。
解释最后的气体压强略小于1.01×107 Pa的2/3原因: 。
(6)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染,下列试剂中①NaCl、②
NH4Cl、③HNO3、④浓H2SO4,能使NaNO2转化为N2的是 。(选填编号)
参考答案:(1)C
(2)3 ; r(N3--)>r (O2--
本题解析:
试题分析:
(1)A.解毒时美蓝将铁元素由正三价变为正二价表现出还原性。错误。B. NaNO2可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,说明NaNO2有强氧化性,它将铁元素由二价变为三价,它本身得到电子被还原,发生还原反应。错误。 C.解毒时高铁血红蛋白铁元素由正三价还原为正二价。高铁血红蛋白得到电子,被还原,发生还原反应。正确。D.中毒过程中血红蛋白显还原性,NaNO2表现氧化性。错误。故选项为C。
(2)钠离子核外电子排布为1s22s22p6,可见在Na+的核外有三种不同能级的电子。Na+、N3-、O2-的核外电子排布都是2、8的电子层结构。对于电子层结构相同的微粒来说,核电荷数越大,微粒的半径就越小。所以它们的半径大小顺序为r(N3--)>r (O2--)>r(Na+) 。
(3)Na、N、O分别与H形成的简单化合物分别是NaH、NH3、H2O。NaH是离子晶体,离子间通过离子键结合,断裂需要消耗较高的中能量,因此熔点较高,而NH3、H2O是分子晶体,分子间以分子间作用力及氢键结合,结合力较小,断裂容易,因此熔沸点较低。故熔点最高的是NaH。
(4)NaNO2发生反应的方程式为:2NaNO2 +4HI =" 2NO↑+" I2 + 2NaI + 2H2O.由方程式可知每有1mol HI被氧化时,转移电子1mol,产生标准状况下的NO气体为22.4L.现在有0.75mol HI被氧化时,则产生的气体在标准状况下产生气体的体积是0.75mol×22.4L/mol=16.8L。
(5)根据题意可得生成N2O的反应方程式为3NO=N2O十NO2。最后的气体压强略小于1.01×107 Pa的2/3原因是因为发生反应2NO2 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,气体的物质的量减少。气体的物质的量越少,容器的压强就越小。所以其压强略小于1.01×107 Pa的2/3。
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,气体的物质的量减少。气体的物质的量越少,容器的压强就越小。所以其压强略小于1.01×107 Pa的2/3。
(6)试剂若能使NaNO2转化为N2,由于N的化合价的变化是由+3→O,化合价降低,得到电子,则加入的物质应该有还原性,元素的化合价较低。分析给出的物质只有NH4Cl符合题意。因此选项为②。
考点:考查氧化还原反应的有关知识及计算、原子的结构、离子半径的比较、晶体类型的判断、化学方程式的书写、外界条件对化学平衡移动的影响的知识。
本题难度:一般