?
?
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=__________。若此时已达平衡,则可求得平衡常数为__________。
(2)下图表示合成NH3反应在时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是__________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6
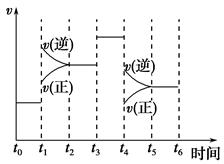
若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH________0(填“大于”或“小于”)。
参考答案:(1)1.5 mol·L-1·s-1 0.25 (2)① 小
本题解析:(1)根据合成氨反应3H2(g)+N2(g) 2NH3(g)和表中数据,计算得v(H2)=1.5 mol·L-1·s-1,达到平衡时各物质的浓度分别为n(H2)=2 mol·L-1,n(N2)=2 mol·L-1,n(NH3)=2 mol·L-1,即可求出平衡常数为0.25。 2NH3(g)和表中数据,计算得v(H2)=1.5 mol·L-1·s-1,达到平衡时各物质的浓度分别为n(H2)=2 mol·L-1,n(N2)=2 mol·L-1,n(NH3)=2 mol·L-1,即可求出平衡常数为0.25。
(2)由图可知,从t1开始是化
本题难度:一般
3、选择题 在固定体积的容器内进行反应2HI(g)?H2(g)+I2(g),达到平衡状态的标志是( )
A.I2(g)的消耗速率等于H2的消耗速率
B.容器中各组分的浓度不随时间变化
C.容器内气体的压强不再变化
D.单位时间内生成n?mol?H2,同时生成n?mol?HI
参考答案:A、无论是否达到平衡,二者速率始终相等,不能说明是否达到了平
本题解析:
本题难度:简单
4、填空题 溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
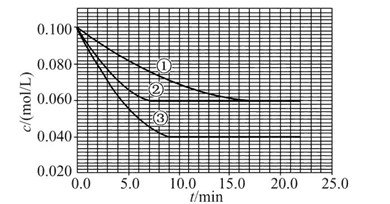
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:②??????????????????;③??????????????????????。
(2)实验②平衡时B的转化率为???????;实验③平衡时C的浓度为????????。
(3)该反应的ΔH??????0,其判断理由是???????????????????????????????。
(4)该反应进行到4.0 min时的平均反应速率:实验②:v(B)=????????????。
参考答案:(1)加催化剂;达到平衡的时间缩短,平衡时A的浓度未变??温
本题解析:这是一道数形结合的反应原理试题,关键是找出图形中①②③三条曲线的转折点:达到平衡的时间①>③>②,但A的平衡浓度关系是①=②>③,说明②是使用了催化剂,③是升高温度。
(1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应
本题难度:一般
5、选择题 一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应:A(s)+2B(g) C(g)+2D(g) ?ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是(??? ) C(g)+2D(g) ?ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是(??? )
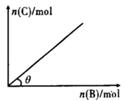
A.增加A的物质的量,正反应速率加快
B.平衡时,其他条件不变,当温度升高时,θ变大
C.图中曲线的斜率表示反应的化学平衡常数
D.平衡时,其他条件不变,再通人B,则反应混合物的温度升高
参考答案:D
本题解析:
试题分析:A、由于A是固体,增加A的量不影响化学反应速率,错误;B、平衡时,其他条件不变,当温度升高时,平衡向逆反应方向移动,θ变小,错误;C、温度一定时,化学平衡常数是定值,故图中曲线的斜率不能表示化学平衡常数,错误;D、通入B,平衡正向移动,反应放出更多的热,导致体系温度升高,正确。
本题难度:一般
|