微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
①原电池是将化学能转化为电能的一种装置????
②原电池的正极发生氧化反应,负极发生还原反应???
③不能自发进行的氧化还原反应,通过原电池装置可以实现???
④碳棒不能用来作原电池的正极???
⑤反应Cu+2Ag+?= Cu2++2Ag?能以原电池的形式实现
A.②⑤
B.①④⑤
C.②③④
D.①⑤
参考答案:D
本题解析:原电池的正极发生还原反应,负极发生氧化反应,②不正确。只有自发进行的氧化还原反应,才能通过原电池装置实现,③不正确。④不正确,碳棒可以导电,可用作电极,所以正确的答案是①⑤,答案选D。
本题难度:简单
2、填空题 生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2等)与H2混合,催化合成甲醇和二甲醚(CH3OCH3)及许多烃类物质等,是生物质能利用的方法之一.
(1)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
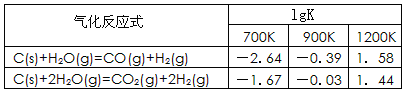
反应:CO(g)+H2O(g)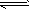 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
(2)甲醇是一种重要的能源和化工原料,工业上合成甲醇的反应为:CO+2H2?CH3OH.现已知:H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8KJ/mol、-283.0KJ/mol和-726.5KJ/mol。则:CH3OH不完全燃烧生成CO和液态H2O的热化学反应方程式 .
(3)在一定温度、压强和催化条件下,工业上用CO和H2反应生成二甲醚,同时产生一种参与大气循环的无机物。则该反应的化学反应方程式为: .
(4)下图左为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极上发生反应的电极反应式为 .
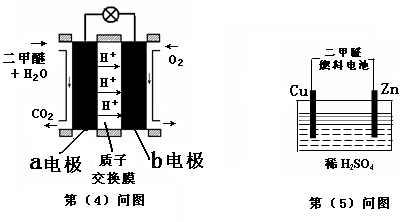
(5)连接下图右装置的电源为(4)问中的二甲醚燃料电池。接通电源一段时间后,观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。则该装置中的Cu电极应与二甲醚燃料电池中 电极(填a或b)相连。通电时发生反应的总的离子反应方程式为: .
参考答案:(1)<; 0.36 (2
本题解析:
试题分析:K1="{" C(CO)·C(H2)} /C(H2O);K2=" {" C(CO2)·C2(H2)} /C2(H2O) ②-①整理得:CO(g)+H2O(g)  CO2(g)+H2(g),它的平衡常数为:K="{" C(CO2)·C(H2)} /{ C(CO) ·C(H2O)}.="K2/K1." K越大,lgK就越大。升高温度K减小,说明升高温度化学平衡向逆反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应。所以正反应为放热反应。所以△H<0.在900K时,该反应平衡常数的对数值lgK ="lgK2/K1=lgK2-lgK1=-0.03+0.39=0.36." (2)由题意可写出CO、CH3OH燃烧的热化学方程式①CO(g)+(1/2)O2(g)=CO2(g) △H=-283.0KJ/mol;②CH3OH(l)+(3/2)O2(g)=CO2(g)+2H2O.②-①得:CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5KJ/mol。(3)根据题意可得反应的化学方程式:3CO+3H2 =(CH3)2O+CO2或者2CO+4H2 =(CH3)2O+ H2O。(4)在燃料电池中,通入燃料的电极作负极,通入氧气的电极作正极。a电极及负极上发生反应的电极反应式是:(CH3)2O-12e-+3H2O=2CO2+12H+。(5)在电解池中观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。说明Cu失去了电子。Cu电极作阳极。二甲醚燃料电池中b电极(即正极)相连。通电时发生反应的总的离子反应方程式为:Cu+2H+
CO2(g)+H2(g),它的平衡常数为:K="{" C(CO2)·C(H2)} /{ C(CO) ·C(H2O)}.="K2/K1." K越大,lgK就越大。升高温度K减小,说明升高温度化学平衡向逆反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应。所以正反应为放热反应。所以△H<0.在900K时,该反应平衡常数的对数值lgK ="lgK2/K1=lgK2-lgK1=-0.03+0.39=0.36." (2)由题意可写出CO、CH3OH燃烧的热化学方程式①CO(g)+(1/2)O2(g)=CO2(g) △H=-283.0KJ/mol;②CH3OH(l)+(3/2)O2(g)=CO2(g)+2H2O.②-①得:CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5KJ/mol。(3)根据题意可得反应的化学方程式:3CO+3H2 =(CH3)2O+CO2或者2CO+4H2 =(CH3)2O+ H2O。(4)在燃料电池中,通入燃料的电极作负极,通入氧气的电极作正极。a电极及负极上发生反应的电极反应式是:(CH3)2O-12e-+3H2O=2CO2+12H+。(5)在电解池中观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。说明Cu失去了电子。Cu电极作阳极。二甲醚燃料电池中b电极(即正极)相连。通电时发生反应的总的离子反应方程式为:Cu+2H+ Cu2++H2↑。
Cu2++H2↑。
考点:考查原电池、电解池的反应原理及化学平衡常数的计算、热化学方程式的书写等知识。
本题难度:困难
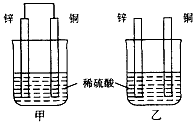
3、选择题 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
 [???? ]
[???? ]
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙快
参考答案:CD
本题解析:
本题难度:简单
4、选择题 关于如图所示的装置的叙述,正确的是( )
A.电流从锌片经导线流向铜片
B.一段时间后,电解质溶液中的硫酸根浓度减小
C.铜是正极,铜片上有气泡产生,锌片质量减少
D.一段时间后,电解质溶液的酸碱性保持不变
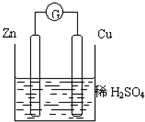
参考答案:A、该原电池中锌作负极,铜作正极,所以电子从负极锌沿导线流向
本题解析:
本题难度:一般
5、选择题 原电池正、负电极的极性不仅与电极材料的性质有关,也与电解质溶液有关。下列由不同材料组成的原电池,电极反应正确的是
A.由Fe、Cu与稀硫酸组成的原电池,其负极反应式为Fe-3e-=Fe3+
B.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为:Mg-2e-+2OH-=Mg(OH)2
C.Pb、Cu与氯化铁溶液组成的原电池,其正极反应式为Cu-2e-=Cu2+
D.Al、Cu与浓硝酸组成的原电池,其负极反应式为Cu-2e-=Cu2+
参考答案:D
本题解析:
试题分析:原电池中较活泼的金属做负极,不活泼的金属做正极,但在实际判断时还需要考虑电解质溶液的性质。A、由Fe、Cu与稀硫酸组成的原电池中铁的金属性强于铜,且铁能和稀硫酸反应,因此其负极是铁,则负极反应式为Fe-2e-=Fe2+,A不正确;B、由Al、Mg与氢氧化钠溶液组成的原电池,镁的金属性强于铝,但能和氢氧化钠溶液反应的是铝,因此铝是负极,镁是正极,则负极反应式为Al-3e-+4OH-=AlO2-+2H2O,B不正确;C、Pb、Cu与氯化铁溶液组成的原电池中铜的金属性强于铅,因此铜是负极,铅是
本题难度:一般